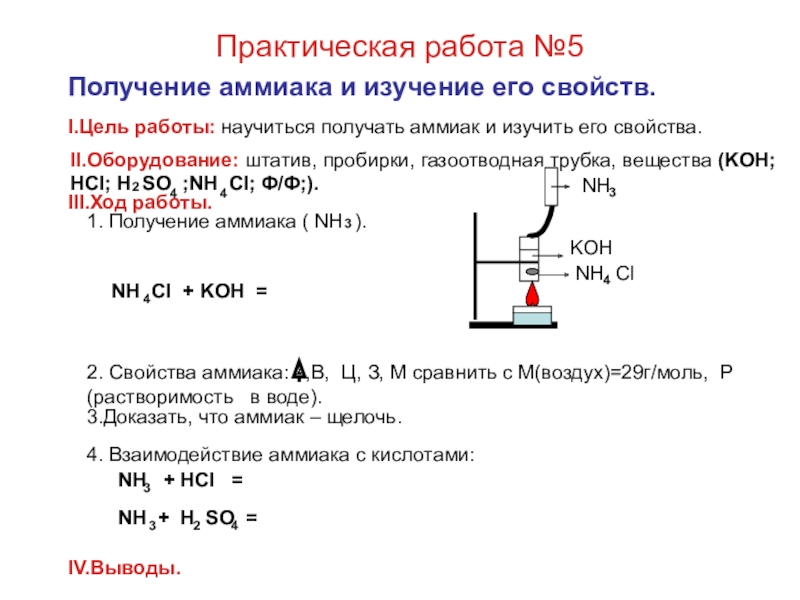
II. Оборудование: штатив с пробирками, вещества ( Zn SO ;Al (SO ) ; NaOH; HCl ).
III.Ход работы.
1) 1. Получение гидроксида алюминия: Al (SO ) + NaOH =
2. Доказательство основных свойств: Al(OH) + HCl =
3. Доказательство кислотных свойств: Al(OH) + NaOH =
2) Аналогично провести доказательство амфотерности гидроксида цинка.
1. Получение гидроксида цинка: Zn SO + NaOH =
2. Доказательство основных свойств: Zn(OH) + HCl =
3. Доказательство кислотных свойств: Zn(OH) + NaOH =
IVВыводы.
2
2
2
2
4
4
4
4
3
3
3
3