- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Получение металлов химия 9 класс
Содержание
- 1. Презентация по теме Получение металлов химия 9 класс
- 2. Тема урока «Получение металлов».Урок химии в
- 3. Цели урока: 1.Познакомить обучающихся с природными соединениями
- 4. Теперь, давайте вспомним прошлую тему: Составьте
- 5. Надеюсь, все справилисьа) 4Аl +3СI2 →2 Al2Cl3
- 6. Проблема! Могут ли металлы находиться
- 7. В природе металлы могут встречаться в виде
- 8. Слайд 8
- 9. В природе металлы встречаются чаще всего в виде
- 10. Слайд 10
- 11. Выполнение лабораторного опыта №13. Ознакомление с
- 12. Результаты опытов оформите в виде таблицы.Подумайте: 1.
- 13. Активные Ме (до Sn) встречаются только в
- 14. Вопрос! Как вы думаете, ребята, какой
- 15. Получением металлов из их соединений занимается важнейшая отрасль промышленности, называемая металлургией.
- 16. Вопрос! Как добиться доступной формы для переработки?Это
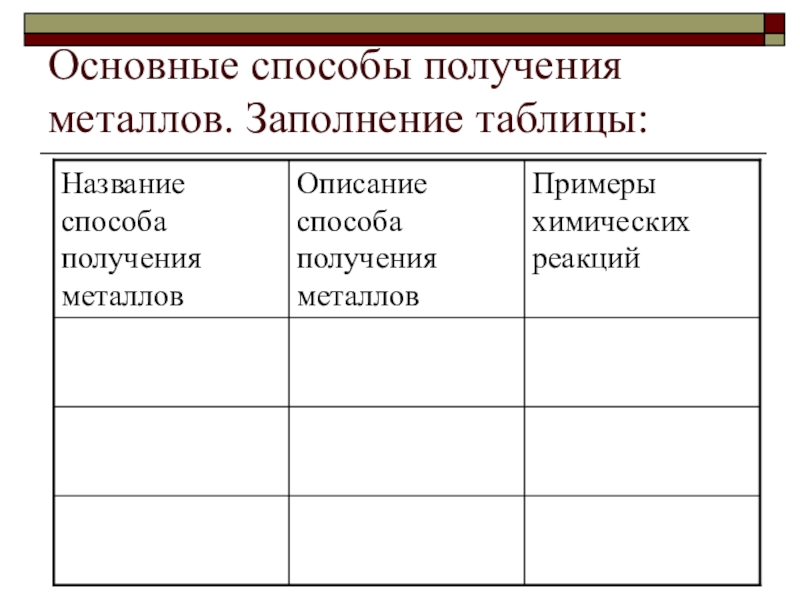
- 17. Основные способы получения металлов. Заполнение таблицы:
- 18. Пирометаллургия.восстановление металлов из их руд, происходящее при
- 19. Гидрометаллургия Методы восстановления металлов
- 20. Электрометаллургия получение Ме с помощью электрического тока
- 21. Термическое разложение соединений : так получают Ме
- 22. Закрепление темы: Предложите цепочку производства :Как можно
- 23. Почти все справились. Молодцы!FeS2→Fe2O3→FeFeS2→SO2→SO3→H2SO41)4FeS2+11O2=2 Fe2O3 +8SO22) Fe2O3+ 3C = 2Fe + 3CO ↑3)2SO2+O2=2SO34)2SO3+H2O=H2SO4PbS→PbO→Pb1)2PbS+3O2=2SO2↑+2PbO2) PbO+CO=Pb+CO2
- 24. Молодцы! Всем спасибо! Домашнее задание:
Слайд 1Здравствуйте, ребята! Мы продолжаем изучать большую главу «Металлы». А тема сегодняшнего
Слайд 2Тема урока
«Получение металлов».
Урок химии в 9 классе.
Учитель
«Металл – всех недр земных владыка»…
Слайд 3Цели урока: 1.Познакомить обучающихся с природными соединениями металлов. 2. Сформировать понятия о
Задачи урока:
Образовательные задачи:
· обобщить знания учащихся об основных свойствах элементов-металлов и образуемых ими простых и сложных веществ.
· закрепить материал по теме «Металлы», навыки решения задач
· выработать умение логически рассуждать, грамотно выражать свои мысли
· развивать умение работать коллективно
Развивающие задачи:
· Развивать знания, умения и навыки по химическим формулам металлов и их соединений
· Развивать речевые навыки, наблюдение и умение делать выводы
· Развивать интерес к предмету
Воспитательные задачи:
· Воспитывать желание учиться с интересом, без принуждения и нагрузок
· Воспитывать самостоятельность мышления посредством саморефлексии
Слайд 4Теперь, давайте вспомним прошлую тему:
Составьте уравнения возможных реакций:
а) Аl +
б) Zn + AgNO3 →
в) MgO + HCl →
г) Аg + FeSO4 →
д) СuСI2 + NaOH →
а) Аg + Н2О →
б) Cu + ZnСI2 →
в) Мg + О2 →
г) Сu + НСI →
д) Fe + CuSO4 →
Слайд 5Надеюсь, все справились
а) 4Аl +3СI2 →2 Al2Cl3
б) Zn + 2AgNO3 →Zn(NO3)2+2Ag
в) MgO + 2HCl
→ MgCl2+ Н2О
г) Аg + FeSO4 → нет реакции
д) СuСI2 +2NaOH → 2NaCl+Cu(OH)2
а) Аg + Н2О → нет реакции
б) Cu + ZnСI2 → нет реакции
в) 2Мg + О2 → 2MgO
г) Zn + 2НСI → ZnCl2+Н2
д) Fe + CuSO4 →FeSO4 +Cu
Слайд 6
Проблема!
Могут ли металлы находиться в природе в свободном ( самородном
Если могут, то какие это металлы?
Это металлы низкой химической активности.
Слайд 7В природе металлы могут встречаться в виде простого вещества (самородки) или
Благородные Ме – Аu, Рt , встречаются в природе только в свободном виде.
Самородок серебра
Самородок золота
Самородок платины
Слайд 9В природе металлы встречаются чаще всего в виде соединений (металлических руд). А
Руды – содержащие металлы природные образования, в которых металлы находятся в количествах, пригодных в технологическом и экономическом отношении для получения металлов в промышленности.
Из 1 тонны медной руды можно получить лишь 4 кг чистой меди
Медная руда
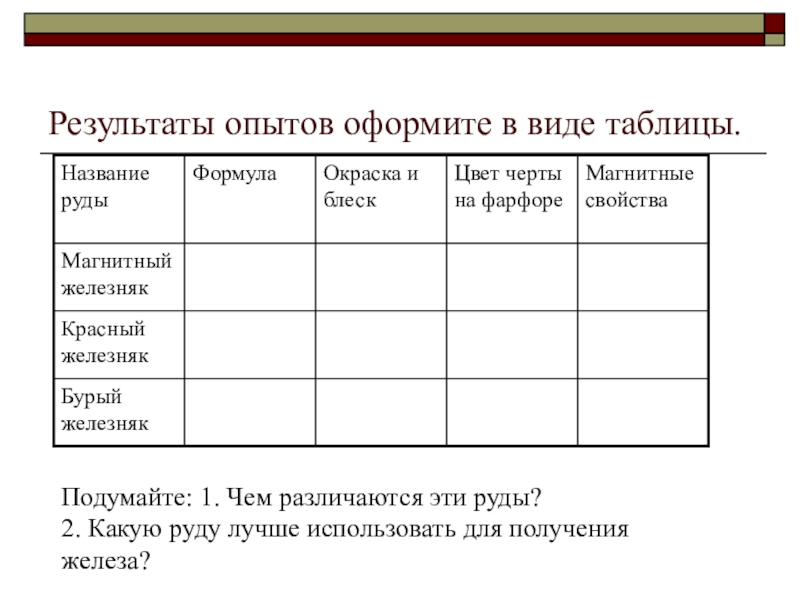
Слайд 11Выполнение лабораторного опыта №13.
Ознакомление с рудами железа. (работа в парах)
Цель:
Образцы: магнитный железняк, красный железняк, бурый железняк.
Содержание и порядок выполнения работы:
Внимательно рассмотрите образцы, выданных вам руд и определите их цвет и блеск.
Возьмите фарфоровую ступку и кусочком руды нанесите на её поверхности черту. Какого цвета получилась черта?
Кусок руды поднесите к компасу. Отклоняется ли стрелка компаса? Если да, то велико ли это отклонение?
Слайд 12Результаты опытов оформите в виде таблицы.
Подумайте: 1. Чем различаются эти руды?
2.
Слайд 13Активные Ме (до Sn) встречаются только в виде соединений. Менее активные
.
хлоридов :сильвинит КСl • NaCl, каменная соль NaCl;
нитратов – чилийская селитра NaNO3;
сульфатов – глауберова соль Na2SO4 * 10 H2O, гипс CaSO4 • 2Н2О;
карбонатов – мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 • MgCO3;
сульфидов :серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS;
фосфатов – фосфориты, апатиты Ca 3(PO4)2 ;
оксидов – магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк, содержащий различные гидроксиды железа (III) Fe2O3 • Н2О.
Слайд 14Вопрос! Как вы думаете, ребята, какой основной химический процесс лежит
• Так как большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления Ме+п, значит для того чтобы их получить в виде Ме0, необходимо про вести процесс восстановления.
Ме+n+ne= Ме0
Слайд 15
Получением металлов из их соединений занимается важнейшая отрасль промышленности, называемая
металлургией.
Слайд 16Вопрос! Как добиться доступной формы для переработки?
Это может быть обжиг руд для перевода
Восстановителями выступают следующие вещества: С (уголь), Н2, СО, Al, Mg, активные металлы — щелочные и щелочноземельные, электрический ток.
Слайд 18Пирометаллургия.
восстановление металлов из их руд, происходящее при высоких температурах
Обжиг в древности
Обжиг (окисление):
2PbS + ЗО2 = 2РЬО + 3SO2↑
Плавка (восстановление):
РЬО + Н2 = Pb + Н2О
WO3 + ЗН2 = W + ЗН2О
TiCl4 + 2Mg = Ti + 2MgCl2
Отраслью пирометаллургии является металлотермия – восстановление Ме из оксидов более активными металлами, чаще алюминием ( алюминотермия). Так получают марганец, хром, молибден, вольфрам.
Сr 2О3 + 2 АI → АI 2О3 + 2 Сr
Слайд 19Гидрометаллургия
Методы восстановления металлов из растворов их солей
CuO + H2SO4 = CuSO4 + Н2О
CuSO4 + Fe = FeSO4 + Сu
Слайд 20Электрометаллургия
получение Ме с помощью электрического тока (электролиз).
Так получают активные
Электролиз расплава:
2 NaCI → 2Na + CI2 ↑
2КCI →2K + CI2↑
Слайд 21Термическое разложение соединений :
так получают Ме в особо чистой форме
Fe(CO)5 → Fe + 5CO
Ni(CO)4→ Ni + 4CO
Микробиологический метод
тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты.
Слайд 22Закрепление темы:
Предложите цепочку производства :
Как можно получить из пирита FeS2 железо
Предложите технологическую цепочку производства свинца из минерала галенита PbS. Запишите уравнения реакций
Слайд 23Почти все справились. Молодцы!
FeS2→Fe2O3→Fe
FeS2→SO2→SO3→H2SO4
1)4FeS2+11O2=2 Fe2O3 +8SO2
2) Fe2O3+ 3C = 2Fe +
3)2SO2+O2=2SO3
4)2SO3+H2O=H2SO4
PbS→PbO→Pb
1)2PbS+3O2=2SO2↑+2PbO
2) PbO+CO=Pb+CO2
Слайд 24Молодцы! Всем спасибо!
Домашнее задание: §12, упр. 1. Выписать
Творческое задание: подготовить сообщение о любом минерале и его использовании.