- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме основания
Содержание
- 1. Презентация по теме основания
- 2. Диссоциация оснований NaOH => Na++OH- Ba(OH)2=>Ba2++2OH-
- 3. Основания - это электролиты, которые при диссоциации образуют катионы металла и гидроксид анионы.
- 4. Классификация оснований по растворимости Растворимые
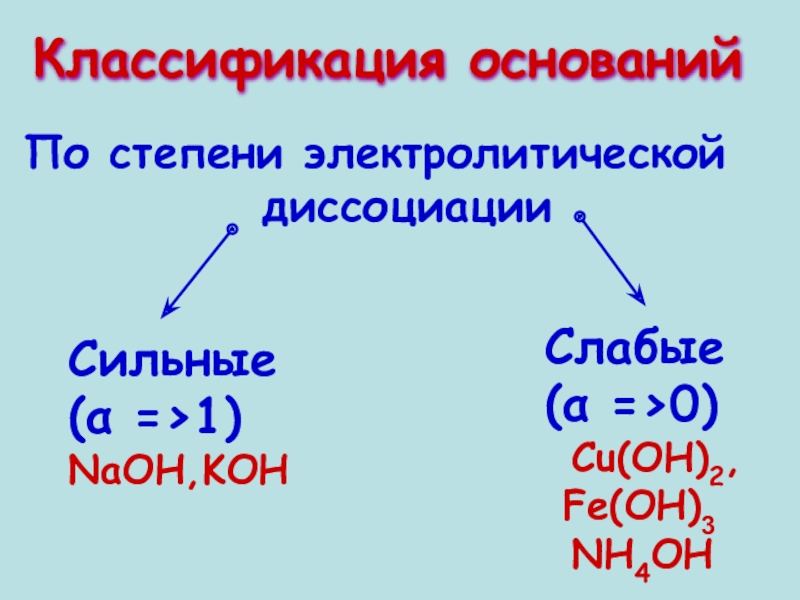
- 5. Классификация оснований Сильные(α =>1)NaOH,KOH
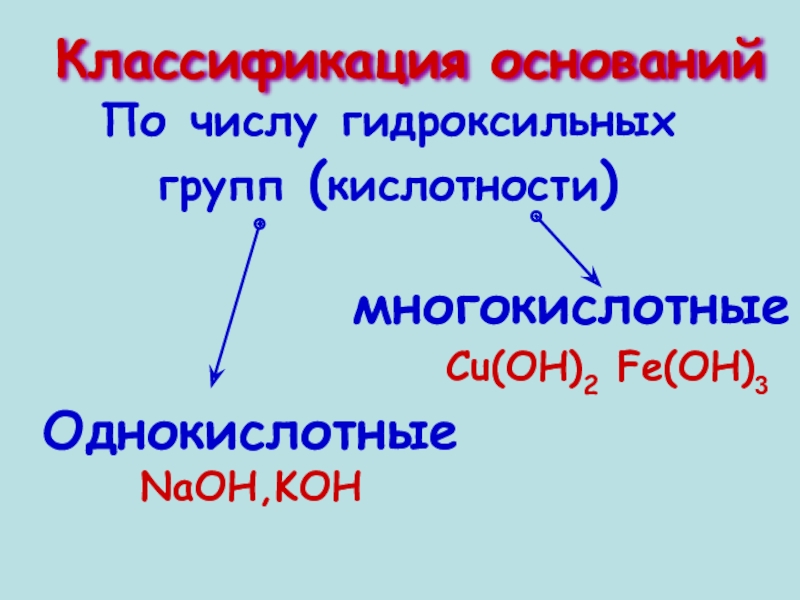
- 6. По числу гидроксильных групп (кислотности) Классификация оснований
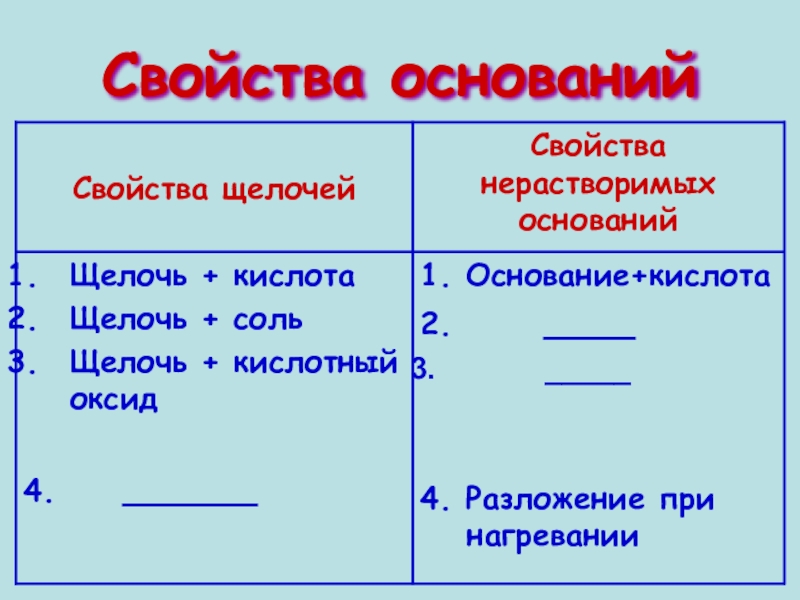
- 7. Свойства оснований
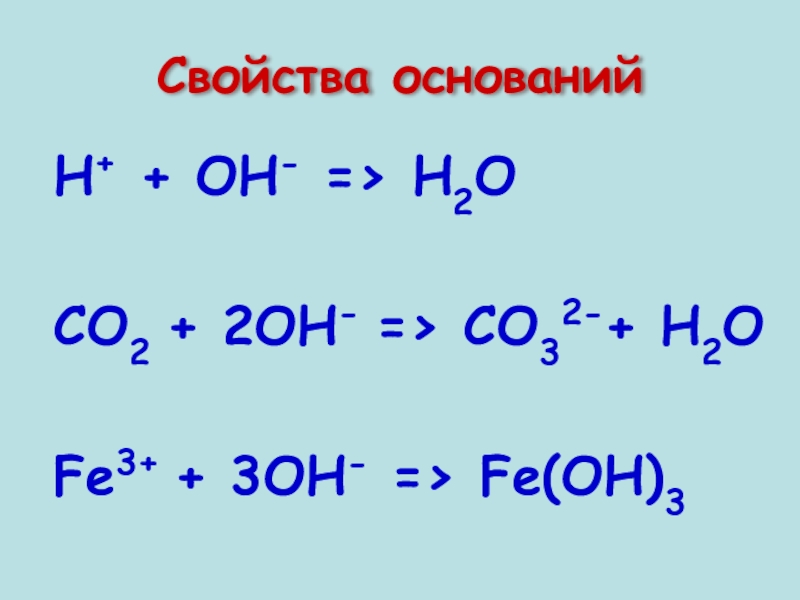
- 8. Свойства оснований Н+ + ОН- => Н2О
Диссоциация оснований NaOH => Na++OH- Ba(OH)2=>Ba2++2OH-
Слайд 3
Основания -
это электролиты, которые при диссоциации образуют катионы металла и
гидроксид анионы.
Слайд 4
Классификация оснований
по растворимости
Растворимые
(щелочи)
NaOHNaOH, KOH,
Ca(OH)2
Нерастворимые
основания
Cu(OH)2
Fe(OH)3
Слайд 5
Классификация оснований
Сильные
(α =>1)
NaOH,KOH
Слабые
(α =>0)
Cu(OH)2,
Fe(OH)3
NH4OH
NH4OH
По степени электролитической
диссоциации