- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Металлы побочных подгрупп - Цинк Ртуть Марганец
Содержание
- 1. Презентация по теме Металлы побочных подгрупп - Цинк Ртуть Марганец
- 2. ПланЦинкРтуть Марганец
- 3. ЦинкЦинк в сплавах был извеетен еще в
- 4. Цинк. Физические свойстваЦинк — металл синевато-белого цвета,
- 5. Цинк. Химические свойства2 Zn + О2 =
- 6. Цинк. Химические свойстваПри нагревании взаимодействует с аммиаком,
- 7. Цинк. Химические свойстваЦинк вытесняет менее активные металлы
- 8. Цинк. Получение2 ZnS + 3 O2 =
- 9. Оксид цинка ZnОПорошок белого цвета. Плавится при
- 10. Гидроксид цинка Zn(ОН)2Обладает амфотерными свойствами, легко растворяется
- 11. РтутьНахождение в природе. Содержание ее в земной
- 12. РтутьФизические свойства. Ртуть — серебристо-белый жидкий металл,
- 13. РтутьВ ртути растворяются многие металлы, образуя амалыамы.
- 14. Ртуть. Химические свойстваРтуть является малоактивным металлом. С
- 15. Ртуть. Химические свойстваВ воде и щелочах ртуть
- 16. Ртуть. ПолучениеНgS + О2 = Нg +
- 17. Ртуть. Химические свойстваОксид ртути сбладает только основными
- 18. МарганецМарганец впервые получили К. В. Шееле и
- 19. Марганец. Физические свойства.Марганец — серебристо-белый металл, плотность
- 20. Марганец. Химические свойстваМарганец образует различные соединения, в
- 21. Марганец. Химические свойстваМарганец легко растворяется в кислотах-неокислителях
- 22. Марганец. Химические свойстваРастворение марганца в кислотах-окислителях сопровождается
- 23. Марганец. Получение1) 3 МnО2 = Мn3O4 +
- 24. Марганец. Кислородные соединенияМарганец образует оксиды МnО, Мn2О3,
- 25. Марганец. Кислородные соединенияОксид марганца (III) Мn2О3 встречается
- 26. Марганец. Кислородные соединенияДиоксид марганца в кислой среде
- 27. Марганец. Кислородные соединенияМанганат калия К2МnO4 самопроизвольно разлагается
- 28. Марганец. Кислородные соединения2 К2МnО4 + Сl2 =
- 29. КОНЕЦ
ПланЦинкРтуть Марганец
Слайд 3Цинк
Цинк в сплавах был извеетен еще в древности. В чистом видеего
получили только в конце ХVIII века.
Нахождение в природе. Содержание цинка в земной коре составляет 8,3*103 %. Его соединения довольно распространены. Чаще других встречается минерал цинковая обманка ZnS, реже — галмей ZnСО3, кремнецинковая руда Zn2SiО4*Н2О, цинковая шпинель ZnО*Аl2O3 и красная цинковая руда, или цинкит, ZnО.
Нахождение в природе. Содержание цинка в земной коре составляет 8,3*103 %. Его соединения довольно распространены. Чаще других встречается минерал цинковая обманка ZnS, реже — галмей ZnСО3, кремнецинковая руда Zn2SiО4*Н2О, цинковая шпинель ZnО*Аl2O3 и красная цинковая руда, или цинкит, ZnО.
Слайд 4Цинк. Физические свойства
Цинк — металл синевато-белого цвета, обладающий металлическим блеском. На
воздухе его поверхность покрывается оксидной пленкой и тускнеет. Цинк плавится при 419,5С, кипит при 913 С.
Легко образует сплавы с другими металлами.
Легко образует сплавы с другими металлами.
Слайд 5Цинк. Химические свойства
2 Zn + О2 = 2 ZnО (оксид цинка)
Zn + Сl2 = ZnСl2 (хлорид цинка)
Zn + S = ZnS (сульфид цинка)
3 Zn + 2 Р = Zn3Р2 (фосфид цинка)
Слайд 6Цинк. Химические свойства
При нагревании взаимодействует с аммиаком, в реэультате чего образуется
нитрид цинка:
3 Zn + 2 NН3 = Zn2N3 + 3 Н2
а также с водой:
Zn + Н2О = ZnО+ Н2
и сероводородом:
Zn+ Н2S = ZnS+ Н2
ВаS + ZnSO4 = ВаSO4 + ZnS
Цинк хорошо растворим в кислотах и щелочах:
Zn + Н2SO4 = ZnSO4 + Н2
4 Zn + 10 НNО3 = 4 Zn(NО3)2 + NН4NО3 + 3 Н2О
Zn + 2 КОH + 2 Н2О = К2[Zn(ОН)4] + Н2
3 Zn + 2 NН3 = Zn2N3 + 3 Н2
а также с водой:
Zn + Н2О = ZnО+ Н2
и сероводородом:
Zn+ Н2S = ZnS+ Н2
ВаS + ZnSO4 = ВаSO4 + ZnS
Цинк хорошо растворим в кислотах и щелочах:
Zn + Н2SO4 = ZnSO4 + Н2
4 Zn + 10 НNО3 = 4 Zn(NО3)2 + NН4NО3 + 3 Н2О
Zn + 2 КОH + 2 Н2О = К2[Zn(ОН)4] + Н2
Слайд 7Цинк. Химические свойства
Цинк вытесняет менее активные металлы из растворов их солей.
СuSO4 + Zn = ZnSO4 + Сu
СdSO4 + Zn = ZnSO4 + Сd
СdSO4 + Zn = ZnSO4 + Сd
Слайд 9Оксид цинка ZnО
Порошок белого цвета. Плавится при температуре около 2000 С.
Плохо растворяется в воде. Обладает амфотерными свойствами. Легко растворяется как в кислотах, так и в щелочах, образуя соли цинка ц и н к а т ы:
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2 KOH + 2 H2O = K2[Zn(OH)4]
При сплавлении взаимодействует с основными и кислотными оксидами:
ZnО + СаО = СаZnО2
ZnО+ SiО2 = ZnSiО3
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2 KOH + 2 H2O = K2[Zn(OH)4]
При сплавлении взаимодействует с основными и кислотными оксидами:
ZnО + СаО = СаZnО2
ZnО+ SiО2 = ZnSiО3
Слайд 10Гидроксид цинка Zn(ОН)2
Обладает амфотерными свойствами, легко растворяется в кислотах и щелочах:
Zn(ОН)2 + Н2SO4 = ZnSO4 + 2 Н2О
Zn(ОН)2 + 2 КОН = К2[Zn(ОН)4]
Он легко растворяется также в аммиаке — образуется аммиакат цинка:
Zn(ОН)2 + 4 NН4ОН = [Zn(NН3)4](ОН)2 + 4 Н2О
Гидроксид цинка образуется при обработке соли цинка щелочью (но не аммиаком) или цинката кислотой:
ZnSO4 + 2 КОН = К2SO4 + Zn(ОН)2
К2[Zn(ОH)4] + Н2SO4 = К2SO4 + Zn(ОH)2 + 2 Н2О
Слайд 11Ртуть
Нахождение в природе. Содержание ее в земной коре составляет 8,3*106 %.
Самородная ртуть встречается в виде вкраплений в породу. Встречается также сульфид ртути НgS, называемый киноварью.
Слайд 12Ртуть
Физические свойства. Ртуть — серебристо-белый жидкий металл, затвердевает при 38,84С, кипит
при 356,95 С. В твердом состоянии обладает хорошей ковкостью и эластичностью.
Слайд 13Ртуть
В ртути растворяются многие металлы, образуя амалыамы. В них металлы ведут
себя, как и в свободном состоянии, но делаются менее активными (образование амальгамы снижает активность аналогично разбавлению). Пары ртути очень ядовиты. Ртуть не выводится из организма человека.
Слайд 14Ртуть. Химические свойства
Ртуть является малоактивным металлом. С кислородом она взаимодействует только
при нагревании:
2 Нg + O2 = 2 НgО
С хлором ртуть взаимодействует нахолоду, образуя хлорид ртути, или сулему:
Нg + Сl2 = НgCl2
Легко взаимодействует ртуть с порошкообразной серой, образуя очень прочное соединение — сульфид ртути:
Нg + S = НgS
2 Нg + O2 = 2 НgО
С хлором ртуть взаимодействует нахолоду, образуя хлорид ртути, или сулему:
Нg + Сl2 = НgCl2
Легко взаимодействует ртуть с порошкообразной серой, образуя очень прочное соединение — сульфид ртути:
Нg + S = НgS
Слайд 15Ртуть. Химические свойства
В воде и щелочах ртуть не растворяется. Она растворяется
в кислотах-окислителях; в концентрированной серной кислоте при нагревании, а в азотной — на холоду. В вависимости от количества ртути образуются соли ртути в степени окисления +1 и +2:
Нg + 2 Н2SO4 = НgSO4 + SO2 + 2 Н2O
3 Нg + 8 НNО3 = 3 Нg(NО3)2 + 2 NО + 4 Н2О
Нg + Нg(NО3)2 = Нg2(NО3)2
Ртуть (II) в хлориде НgСl2, восстанавливается металлической ртутью до ртути (I):
НgСl2 + Нg = Нg2Сl2 (каломель)
Нg + 2 Н2SO4 = НgSO4 + SO2 + 2 Н2O
3 Нg + 8 НNО3 = 3 Нg(NО3)2 + 2 NО + 4 Н2О
Нg + Нg(NО3)2 = Нg2(NО3)2
Ртуть (II) в хлориде НgСl2, восстанавливается металлической ртутью до ртути (I):
НgСl2 + Нg = Нg2Сl2 (каломель)
Слайд 17Ртуть. Химические свойства
Оксид ртути сбладает только основными свойствами
НgО+ 2 НСl =
НgСl2 + Н2O
НgО + 2 НNО3 = Нg(NО3)2 + Н2О
В воде оксид ртути не растворяется и при действии щелочей на растворы солей ртути (II) выпадает в осадок:
НgСl2 + 2 КОН = 2 КСl + НgО + Н2О
Нg(NО3)2 + 2 КОН = 2 КNО3 + НgО + Н2О
В соединениях ртути со степенью окисления +1 два атома ртути соединяются между собой ковалентной связью. При дсйствии щелочей на соли ртути (I) выпадают металлическая ртуть и оксид ртути (II):
Нg(NО3)2 + 2 КОН = 2 КNО3 + НgО + Нg + Н2О
НgО + 2 НNО3 = Нg(NО3)2 + Н2О
В воде оксид ртути не растворяется и при действии щелочей на растворы солей ртути (II) выпадает в осадок:
НgСl2 + 2 КОН = 2 КСl + НgО + Н2О
Нg(NО3)2 + 2 КОН = 2 КNО3 + НgО + Н2О
В соединениях ртути со степенью окисления +1 два атома ртути соединяются между собой ковалентной связью. При дсйствии щелочей на соли ртути (I) выпадают металлическая ртуть и оксид ртути (II):
Нg(NО3)2 + 2 КОН = 2 КNО3 + НgО + Нg + Н2О
Слайд 18Марганец
Марганец впервые получили К. В. Шееле и Ю. Ган в 1774
г.
Нахождение в природе. По распространению в природе марганец занимает место после железа. Содержание его в земной коре составляет 0,1 %. Основным минералом, в виде которого марганец встречается в рудах, является пиролюзит МnО2. Кроме пиролюзитовых марганцевых руд встречаются марганцевые руды, содержащие браунит Mn2О3, манганит МnО(ОН), гаусманит Мn3O4 и марганцевый шпат МnCO3.
Нахождение в природе. По распространению в природе марганец занимает место после железа. Содержание его в земной коре составляет 0,1 %. Основным минералом, в виде которого марганец встречается в рудах, является пиролюзит МnО2. Кроме пиролюзитовых марганцевых руд встречаются марганцевые руды, содержащие браунит Mn2О3, манганит МnО(ОН), гаусманит Мn3O4 и марганцевый шпат МnCO3.
Слайд 19Марганец. Физические свойства.
Марганец — серебристо-белый металл, плотность его 7,2 г/см3. Он
твердый и хрупкий, при 1260С плавится, а при 2120 С закипает. На воздухе металл покрывается пестрыми пятнами оксидной пленки, которая предохраняет его от дальнейшего окисления.
Слайд 20Марганец. Химические свойства
Марганец образует различные соединения, в которых проявляет степень окисления
+2, +3, +4, +6 и +7. Соединения марганца с другими степенями окисления малохарактерны и встречаются очень редко.
Мn + С2 = МпСl2 (хлорид марганца (II))
Мn + S = МnS (cулъфид марганца {II))
3 Мn + 2 Р = Мn3Р2 (фосфид марганца (II))
3 Мn + N2 = Мn3N2 (нитрид марганца (II))
2 Мn + N2 = Мn2Si (силицид марганца (II))
Мn + С2 = МпСl2 (хлорид марганца (II))
Мn + S = МnS (cулъфид марганца {II))
3 Мn + 2 Р = Мn3Р2 (фосфид марганца (II))
3 Мn + N2 = Мn3N2 (нитрид марганца (II))
2 Мn + N2 = Мn2Si (силицид марганца (II))
Слайд 21Марганец. Химические свойства
Марганец легко растворяется в кислотах-неокислителях с выделением водорода:
Мn
+ 2 НСl = МnСl2 + Н2
Мn + Н2SO4(разб.) = МnSO4 + Н2
Он растворяется также в воде в присутствии соединений, дающих при гидролизе кислую реакцию:
Мn + 2 Н2О + 2 NН4Сl = МnСl2 + 2 NН4ОН + Н2
Мn + Н2SO4(разб.) = МnSO4 + Н2
Он растворяется также в воде в присутствии соединений, дающих при гидролизе кислую реакцию:
Мn + 2 Н2О + 2 NН4Сl = МnСl2 + 2 NН4ОН + Н2
Слайд 22Марганец. Химические свойства
Растворение марганца в кислотах-окислителях сопровождается выделением продуктов восстановления этих
кислот:
Мn + 2 Н2SO4(конц.) = МnSO4 + SO2 + 2 Н2О
Мn + 4 НNО3 (конц.) = Мn(NО3)2 + 2 NО + 2 Н2О
3 Мn + 8 НNОз (разб.) = 3 Мn(NО3)2 + 2 NО2 + 4 H2О
Марганец может восстанавливать многие оксиды металлов и по этому используется в металлургии:
5 Мn + Nb2О5 = 5 MnО + 2 Nb
3 Мn + Fе2О3 = 3 МnО + 2 Fе
Мn + 2 Н2SO4(конц.) = МnSO4 + SO2 + 2 Н2О
Мn + 4 НNО3 (конц.) = Мn(NО3)2 + 2 NО + 2 Н2О
3 Мn + 8 НNОз (разб.) = 3 Мn(NО3)2 + 2 NО2 + 4 H2О
Марганец может восстанавливать многие оксиды металлов и по этому используется в металлургии:
5 Мn + Nb2О5 = 5 MnО + 2 Nb
3 Мn + Fе2О3 = 3 МnО + 2 Fе
Слайд 23Марганец. Получение
1) 3 МnО2 = Мn3O4 + O2
2) 3 Мn3О4 +
8 Аl = 4 Аl2O3 9 Мn
Для получения ферромарганца, используемого в металлургии, смесь железной руды и пиролюзита восстанавливают коксом в электропечах:
Fе2О3 + МnО2 + 5 С = 2Fе*Мn + 5 СО
Для получения ферромарганца, используемого в металлургии, смесь железной руды и пиролюзита восстанавливают коксом в электропечах:
Fе2О3 + МnО2 + 5 С = 2Fе*Мn + 5 СО
Слайд 24Марганец. Кислородные соединения
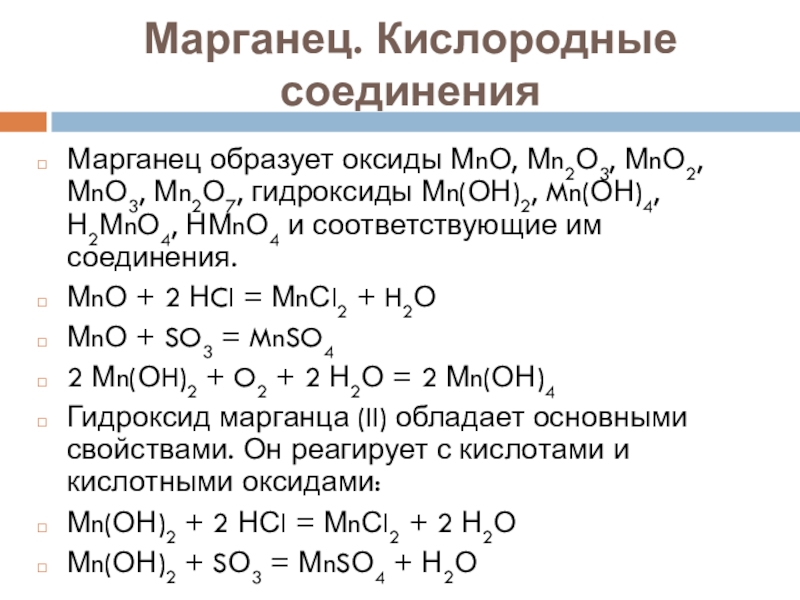
Марганец образует оксиды МnО, Мn2О3, МnО2, МnО3, Мn2О7, гидроксиды
Мn(ОН)2, Mn(ОН)4, Н2МnО4, НМnО4 и соответствующие им соединения.
МnО + 2 НCl = МnСl2 + H2О
МnО + SO3 = MnSO4
2 Мn(ОH)2 + O2 + 2 Н2О = 2 Мn(ОН)4
Гидроксид марганца (II) обладает основными свойствами. Он реагирует с кислотами и кислотными оксидами:
Мn(ОН)2 + 2 НСl = МnСl2 + 2 Н2О
Мn(ОН)2 + SО3 = МnSО4 + Н2О
МnО + 2 НCl = МnСl2 + H2О
МnО + SO3 = MnSO4
2 Мn(ОH)2 + O2 + 2 Н2О = 2 Мn(ОН)4
Гидроксид марганца (II) обладает основными свойствами. Он реагирует с кислотами и кислотными оксидами:
Мn(ОН)2 + 2 НСl = МnСl2 + 2 Н2О
Мn(ОН)2 + SО3 = МnSО4 + Н2О
Слайд 25Марганец. Кислородные соединения
Оксид марганца (III) Мn2О3 встречается в природе в виде
минерала браунита. В лаборатории образуется при осторожном нагревании МnО2 при температуре 530-940С:
4 МnО2 = 2 Мn2О3 + O2
При более высокой температуре разложение диоксида сопровождается образованием оксида Мn3O4.
3 МnО2 = Мn3О4 + O2
2 МnО2 + 4 НNО3 = 2 Мn(NО3)2 + 2 Н2О + O2
4 МnО2 = 2 Мn2О3 + O2
При более высокой температуре разложение диоксида сопровождается образованием оксида Мn3O4.
3 МnО2 = Мn3О4 + O2
2 МnО2 + 4 НNО3 = 2 Мn(NО3)2 + 2 Н2О + O2
Слайд 26Марганец. Кислородные соединения
Диоксид марганца в кислой среде проявляет окислительные свойства:
МnО2
+ 4 НСl = МnСl2 + Сl2 + 2 Н2О
МnО2 + 2 FеSO4 + 2 Н2SO4 = МnSO4 + Fе2(SO4)3 + 3 Н2О
При сплавили оксида марганца (IV) со щелочами без доступа воздуха образуется манганит, или манганат (IV):
2 МnО2 + 2 КОН = К2МnО3 + Н2О
МnО2 + 2 FеSO4 + 2 Н2SO4 = МnSO4 + Fе2(SO4)3 + 3 Н2О
При сплавили оксида марганца (IV) со щелочами без доступа воздуха образуется манганит, или манганат (IV):
2 МnО2 + 2 КОН = К2МnО3 + Н2О
Слайд 27Марганец. Кислородные соединения
Манганат калия К2МnO4 самопроизвольно разлагается на перманганат калия и
диоксид марганца:
3 К2МnО4 + 2 Н2О = 2 КМnО4 + МnО2 + 4 КОН
2 КМnО4 +10 КВг + 8 Н2SO4 = 2 МпSO4 + 6 К2SO4 + 5 Вr2 + 8 Н2О
В щелочной среде перманганат калия восстанавливается до манганата:
2 КМnО4 + К2SO3 + 2 КОН = К2SO4 + 2 К2МnO4 + Н2О
В нейтральной или слабощелочной среде перманганат калия восстанавливается до диоксида марганца:
2 КМnО4 + С6Н5СН3 = 2 КОН + 2 МnО2 + С6Н5СООН
2 КМnО4 + 3 МnSO4 + 2 Н2О = 5 МnО2 + К2SО4 + 2 Н2SО4
3 К2МnО4 + 2 Н2О = 2 КМnО4 + МnО2 + 4 КОН
2 КМnО4 +10 КВг + 8 Н2SO4 = 2 МпSO4 + 6 К2SO4 + 5 Вr2 + 8 Н2О
В щелочной среде перманганат калия восстанавливается до манганата:
2 КМnО4 + К2SO3 + 2 КОН = К2SO4 + 2 К2МnO4 + Н2О
В нейтральной или слабощелочной среде перманганат калия восстанавливается до диоксида марганца:
2 КМnО4 + С6Н5СН3 = 2 КОН + 2 МnО2 + С6Н5СООН
2 КМnО4 + 3 МnSO4 + 2 Н2О = 5 МnО2 + К2SО4 + 2 Н2SО4
Слайд 28Марганец. Кислородные соединения
2 К2МnО4 + Сl2 = 2 КМnО4 + 2
КСl
В настоящее время перманганат калия получают электролитическим окислением манганата:
МnO42 е = МnO4
В аналитической химии перманганат калия применяют для количественного определения веществ, обладающих восстановительными свойствами (Fе2, Sn2, АsО33, Н2О2, и др.). Этот метод анализа называется перманганатометрией.
В настоящее время перманганат калия получают электролитическим окислением манганата:
МnO42 е = МnO4
В аналитической химии перманганат калия применяют для количественного определения веществ, обладающих восстановительными свойствами (Fе2, Sn2, АsО33, Н2О2, и др.). Этот метод анализа называется перманганатометрией.