Подготовила:
преподаватель химии, биологии
Лебедева Евгения Владимировна
ГБПОУ РА «Майкопский индустриальный техникум», г. Майкоп, Республика Адыгея
2019 год
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме: Комплект оценочных материалов для проведения промежуточной аттестации по предмету Химия в СПО
Содержание
- 1. Презентация по теме: Комплект оценочных материалов для проведения промежуточной аттестации по предмету Химия в СПО
- 2. 1. Общие положения.1.1. Комплект оценочных материалов предназначен для
- 3. 2. Результаты освоения дисциплины, подлежащие проверке.В
- 4. З4. Важнейшие вещества и материалы: важнейшие
- 5. Периодической системе Д.И. Менделеева; общие химические
- 6. использовать приобретенные знания и умения в
- 7. 3. Распределение оценивания результатов обучения по видам контроля.Формы контроля и оценивания
- 8. 4. Комплект оценочных материалов для проведения рубежного
- 9. А3. Из перечисленных веществ выберите формулы солей:а)
- 10. А7. Количество групп в периодической системе:а) 10; б)
- 11. Часть 2 (В)В1. Вычислите относительные молекулярные массы
- 12. Ключи к заданиям.Тема: «Общая и неорганическая химия»
- 13. Часть 2 (В)В1. Mr(HMnO4) = 1 +
- 14. Дано:В5. Решение:= 0,5 мольОтвет: объем =11,2 л
- 15. 4.2. Условия выполнения задания.1. Место выполнения задания:
- 16. 4.3. Критерии оценки результата.
- 17. 5. Комплект экзаменационных (контрольных) материалов для дифференцированного
- 18. А2. Электронная формула атома бериллия (Be): а) 1s22s22p1 б)
- 19. А5. Какие из перечисленных химических веществ являются
- 20. А8. Формула сахарозы: а) C12H22O11 б) C6H5OH в) (C6H10O5)n г) C6H12O6А9.
- 21. Часть 2 (В)В1. Определите относительную молекулярную массу
- 22. В4. Осуществите цепочку превращений, дайте названия образующимся
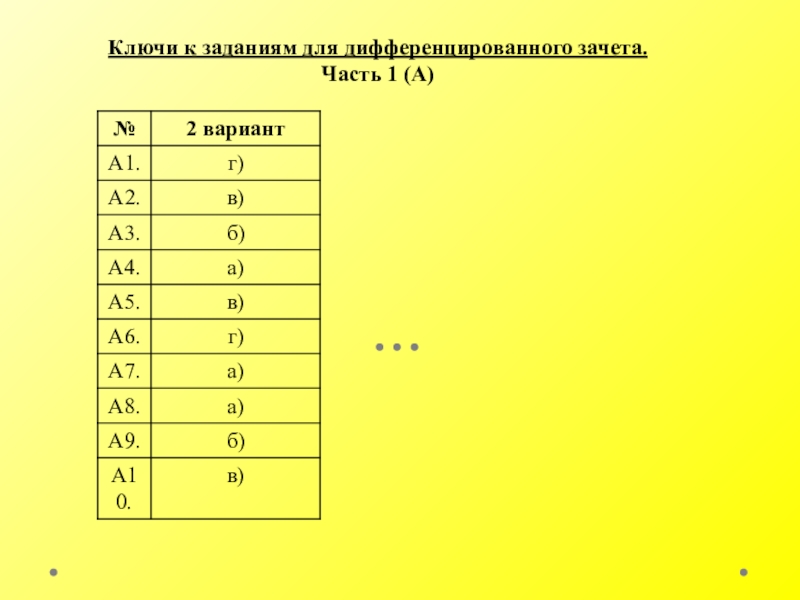
- 23. Ключи к заданиям для дифференцированного зачета.Часть 1 (А)
- 24. Часть 2 (В)В1. Mr(C5H11NH2) = 12 ∙
- 25. В5. Дано: Решениеm(Zn) = 39 г 0,6 моль х
- 26. 5.2. Требования к структуре и оформлению письменного
- 27. 5.3. Условия выполнения заданий:1. Место выполнения задания:
- 28. 6. Пакет экзаменатора.6.1. Тип задания - контрольное
- 29. «3» (удовлетворительно)Студент раскрыл более, чем на 50%
- 30. 6.3. Условия выполнения заданийВремя выполнения задания мин./час.
- 31. Литература для экзаменующихся:1. Таблица «Периодическая система химических
- 32. Дополнительная литература для экзаменатора1. Габриелян О.С. Общая
- 33. 6.4. Оценочная ведомость по дисциплинеОценочная ведомость по
Слайд 1Презентация по теме: «Комплект оценочных материалов для проведения промежуточной аттестации по
Слайд 21. Общие положения.
1.1. Комплект оценочных материалов предназначен для проведения промежуточной аттестации при
23.01.03. «Автомеханик»
15.01.05. «Сварщик (ручной и частично механизированной сварки наплавки))»
13.01.05. «Электромонтёр по техническому обслуживанию электростанций и сетей»
1.2. Проводится за счет часов, отводимых на освоение учебной дисциплины.
1.3. Форма проведения итогового контроля.
В форме дифференцированного зачета.
Слайд 3
2. Результаты освоения дисциплины, подлежащие проверке.
В результате изучения учебной дисциплины
знать (З):
З1. Важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем газообразных веществ, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
З2. Основные законы химии: сохранения массы веществ, постоянства состава веществ, Периодический закон Д.И. Менделеева;
З3. Основные теории химии; химической связи, электролитической диссоциации, строения органических и неорганических соединений;
Слайд 4
З4. Важнейшие вещества и материалы: важнейшие металлы и сплавы; серная,
уметь (У):
У1. Называть: изученные вещества по тривиальной или международной номенклатуре;
У2. Определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических и органических соединений, окислитель и восстановитель, принадлежность веществ к разным классам неорганических и органических соединений;
У3. Характеризовать: элементы малых периодов по их положению в
Слайд 5
Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных
У4. Объяснять: зависимость свойств веществ от их состава и строения, природу химической связи (ионной ковалентной, металлической и водородной), зависимость скорости химической реакции и положение химического равновесия от различных факторов;
У5. Выполнять химический эксперимент: по распознаванию важнейших неорганических и органических соединений;
У6. Проводить: самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
У7. Связывать: изученный материал со своей профессиональной деятельностью;
У8. Решать: расчетные задачи по химическим формулам и уравнениям.
Слайд 6
использовать приобретенные знания и умения в практической деятельности и повседневной
И1. Для объяснения химических явлений, происходящих в природе, быту и на производстве;
И2. Для определения возможности протекания химических превращений в различных условиях и оценки их последствий; экологически грамотного поведения в окружающей среде; оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
И3. Для безопасного обращения с горючими и токсичными веществами и лабораторным оборудованием;
И4. Для приготовления растворов заданной концентрации в быту и на производстве;
И5. Для критической оценки достоверности химической информации, поступающей из разных источников.
Слайд 73. Распределение оценивания результатов обучения по видам контроля.
Формы контроля и оценивания
Слайд 84. Комплект оценочных материалов для проведения рубежного контроля. 4.1. Задания для
Тема «Общая и неорганическая химия».
Вариант №1
Часть 1 (А)
А1. Раздел «Общая химия» изучает:
а) соединения углеродов;
б) основные понятия и законы химии;
в) соединения химических элементов;
г) физические явления.
А2. Закон постоянства состава веществ был открыт:
а) Ж. Прустом; б) Д.И. Менделеевым;
в) А. Лавуазье; г) М.В. Ломоносовым.
Слайд 9А3. Из перечисленных веществ выберите формулы солей:
а) KOH, CO2, NaCl; б) NaHCO3,
в) H2SO4, Cu(OH)2, H2O; г) P2O5, NO, CuO.
А4. Вещество, являющееся неэлектролитом:
а) сахар (C12H22O11); б) H2SO4;
в) NaCl; г) KOH.
А5. Для соединения NaCl характерен следующий тип химической связи:
а) водородная связь; б) металлическая связь;
в) ионная связь; г) ковалентная полярная связь.
А6. В кислой среде окраска индикаторов: лакмус, фенолфталеин, метилоранж соответственно:
а) черный, красный, желтый; б) красный, бесцветный, кроваво-
красный
в) синий, малиновый, желтый; г) малиновый, желтый, красный
Слайд 10А7. Количество групп в периодической системе:
а) 10; б) 8;
в) 7; г) 5.
А8. Тепловой
а) количество теплоты, необходимое для реакции;
б) количество поглощаемого или выделяемого тепла в ходе реакции;
в) количество поглощаемой или выделяемой теплоты, выражается в кДж.
А9. Смеси твердых и жидких веществ, нерастворимых друг в друге – это…:
а) золи; б) суспензии;
в) эмульсии; г) гели.
А10. Какие из перечисленных химических веществ являются неметаллами:
а) Al, K, Zn; б) Cl2, Fe, F2;
в) C, N2, O2; г) Si, Cu, P
Слайд 11Часть 2 (В)
В1. Вычислите относительные молекулярные массы для следующих веществ:
HMnO4, Al2(SO4)3.
В2.
В3. Напишите молекулярное, полное ионное и сокращенное ионное уравнения реакций между следующими веществами:
хлорид бария (BaCl2) и сульфат кальция (CaSO4).
В4. Осуществите цепочку превращений. Напишите уравнения соответствующих реакций, назовите образующиеся вещества:
Mg→MgO→Mg(OH)2→MgCl2.
В5. Рассчитайте, какой объем водорода (н.у.) образуется при взаимодействии 28 г. железа (II) с соляной кислотой.
Слайд 154.2. Условия выполнения задания.
1. Место выполнения задания: задания выполняются в аудитории
2. Максимальное время выполнения задания: 1час 10 мин.
3. Студенты могут использовать следующее оборудование: бумажный носитель для записывания ответов, шариковую ручку, чертежные принадлежности, таблицы: «Периодическая система химических элементов Д.И.Менделеева», «Растворимость кислот, оснований и солей в воде», калькулятор.
Слайд 175. Комплект экзаменационных (контрольных) материалов для дифференцированного зачета.
5.1. Задания для проведения
Текст заданий для проведения дифференцированного зачета по химии:
Вариант № 2
Часть 1 (А)
А1. Какой химический элемент располагается в периодической системе под порядковым номером №16:
а) фосфор
б) кальций
в) алюминий
г) сера
Слайд 18А2. Электронная формула атома бериллия (Be):
а) 1s22s22p1
б) 1s22s22p63s2
в) 1s22s2
г) 1s1
А3. Теория
а) Ломоносовым М.В.
б) Бутлеровым А.М.
в) Менделеевым Д.И.
А4. Формулы оксида, основания, соли соответственно:
а) BaO, Fe(OH)2, NaCl
б) SO2, K2O, NaOH
в) P2O5, Na2O, CaCl2
г) P2O5, SO3, Ca(OH)2
Слайд 19А5. Какие из перечисленных химических веществ являются неметаллами:
а) Al, K, Zn
б)
в) C, N2, O2
г) Si, Cu, P
А6. В листьях крапивы, хвои ели, сосны содержится следующая карбоновая кислота:
а) уксусная кислота
б) молочная кислота
в) валериановая кислота
г) муравьиная кислота
А7. Этанол в воздухе горит:
а) синеватым пламенем
б) желтым пламенем
в) зеленым пламенем
г) красным пламенем
Слайд 20А8. Формула сахарозы:
а) C12H22O11
б) C6H5OH
в) (C6H10O5)n
г) C6H12O6
А9. Ксантопротеиновая реакция – это
а) действие на белок гидроксида натрия и сульфата меди (II);
б) действие на белок концентрированной азотной кислоты при нагревании;
в) действие на белок ацетата свинца;
г) действие на белок серной кислоты.
А10. Полиэтилен получают реакцией полимеризации:
а) карбида кальция
б) муравьиной кислоты
в) этилена
г) метана
Слайд 21Часть 2 (В)
В1. Определите относительную молекулярную массу для C5H11NH2.
В2. Напишите сокращенное
HCl + NaOH = NaCl + H2O
В3. Установите соответствие между химическими формулами и названиями неорганических и органических веществ:
Химическая формула Название веществ
1. HNO3 А. Уксусная кислота
2. CH3COOH Б. Азотная кислота
3. C6H12O6 В. Метан
Г. Глюкоза
Д. Серная кислота
Слайд 22В4. Осуществите цепочку превращений, дайте названия образующимся веществам:
С2H6→C2H5Cl→C2H5OH→C2H5ONa
В5. Задача.
При растворении 39г.
Слайд 24Часть 2 (В)
В1. Mr(C5H11NH2) = 12 ∙ 5 + 1 ∙
В2. H+ + OH- = H2O
В3.1 – Б
2 – А
3 – Д
В4.1) С2H6 + Cl2 = C2H5Cl + HCl
(хлорэтан)
2) С2H5Cl + KOH = C2H5OH + KCl
(этанол)
3) C2H5OH + Na = C2H5ONa+ H2↑
(этилат натрия)
Слайд 25В5. Дано: Решение
m(Zn) = 39 г 0,6 моль х моль
V(H2) - ? Zn
1 моль 1 моль
1) M(Zn) = 65 г/моль
2)
3)
4) V(H2) = 0,6 моль ∙ 22,4 л/моль = 13,44 л
Ответ: объем водорода равен 13,44 л.
Слайд 265.2. Требования к структуре и оформлению письменного дифференцированного зачета:
При выполнении задания
При выполнении задания № 2 (В) необходимо показать уровень знаний по соотношению причин и следствий химических процессов и закономерностей, осуществлению цепочек превращений, решению расчетных задач по химическим формулам и уравнениям, систематизировать химические знания и факты.
Слайд 275.3. Условия выполнения заданий:
1. Место выполнения задания: задания выполняются в аудитории
2. Максимальное время выполнения задания: 1 час 10 мин.
3. Студенты могут использовать следующее оборудование: бумажный носитель для записывания ответов, шариковую ручку, чертежные принадлежности, таблицы: «Периодическая система химических элементов Д.И.Менделеева», «Растворимость кислот, оснований и солей в воде», калькулятор.
Слайд 286. Пакет экзаменатора.
6.1. Тип задания - контрольное тестирование.
6.2. Оценка результатов выполнения
«5» (отлично)
Студент в полном объеме ответил на все вопросы, умеет работать со всеми видами источников, проявив самостоятельность и знания межпредметного характера, применять принципы учебной дисциплины в жизни.
«4» (хорошо)
Студент раскрыл содержание вопросов, но в его ответе содержатся недочеты или одна не грубая ошибка. Студент может самостоятельно добывать знания, пользуясь различными источниками, имеет развитые практические умения, но не обязательно их применять.
Слайд 29«3» (удовлетворительно)
Студент раскрыл более, чем на 50% содержание вопросов, но его
«2» (неудовлетворительно)
Студент раскрыл менее чем на 50% содержание вопросов, его ответ содержит более двух грубых ошибок. Студент не умеет самостоятельно работать с источниками, не знает принципов учебной дисциплины, у него не сформированы знания и умения.
Слайд 306.3. Условия выполнения заданий
Время выполнения задания мин./час. : 1 час 10
Требования охраны труда: соблюдать гигиенические требования: к оборудованию учебного кабинета, к воздушно – тепловому режиму, к длительности проветривания учебного помещения, к естественному и искусственному освещению, к режиму образовательного учреждения, к санитарному состоянию и содержанию учебного кабинета. Соблюдать правила техники безопасности для студентов в кабинете химии.
Оборудование: бумажный носитель для записывания ответов, шариковая ручка, чертежные принадлежности, таблицы: «Периодическая система химических элементов Д.И.Менделеева», «Растворимость кислот, оснований и солей в воде», калькулятор.
Слайд 31Литература для экзаменующихся:
1. Таблица «Периодическая система химических элементов Д.И.Менделеева».
2. Таблица «Растворимость
3. Габриелян О.С. Химия. 10 класс. Базовый уровень: учебник для общеобразовательных учреждений. – М.: Дрофа, 2008.
4. Габриелян О.С. Химия. 11 класс. Базовый уровень: учебник для общеобразовательных учреждений. – М.: Дрофа, 2008.
5. Егоров А.С. Как сдать ЕГЭ по химии на 100 баллов. Изд. 2-е – Ростов н/Д: Феникс, 2004.
6. Новошинский И.И. Органическая химия: 11 класс. /И.И. Новошинский, Н.С. Новошинская. – Краснодар: «Советская Кубань», 2004.
7. Турчен Д.Н. Химия. Расчетные задачи. – М.: Издательство «Экзамен», 2009.
Слайд 32Дополнительная литература для экзаменатора
1. Габриелян О.С. Общая химия в тестах, задачах,
2. Репетитор по химии. /Под редакцией А.С. Егорова. – Ростов н/Д: Феникс, 2005.
3. Лидин Р.А. Химия: «Органическая химия»: экспресс-репетитор для подготовки к ЕГЭ. – М.: АСТ: Астрель; Владимир: ВКТ, 2011.
4. Новошинский И.И., Новошинская Н.С. Сборник самостоятельных работ по органической химии. 11 класс. – М.: ООО «ТИД «Русское слово – РС», 2007.
5. Рябов М.А. Сборник задач и упражнений по химии: 9 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана. «Химия: неорганическая химия: органическая химия. 9 класс». – М.: Издательство «Экзамен», 2010.
6. Ширшина Н.В. Химия. 10-11 классы: индивидуальный контроль знаний. Карточки-задания. – Волгоград: Учитель, 2011.
Слайд 336.4. Оценочная ведомость по дисциплине
Оценочная ведомость по дисциплине «Химия»
________________________________________________________________
(Ф.И.О.)
студент (ка) ______
(указать код и наименование)
успешно освоил (ла) дисциплину «Химия»
в объеме _____ часов с «____» ________201__ г. по «____»______201__ г.
«___» _____________________ 201__ г.
Преподаватель _______________________ Лебедева Е.В.