- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии Кальций и его соединения.
Содержание
- 1. Презентация к уроку химии Кальций и его соединения.
- 2. Общая характеристика. Кальций – элемент 4 периода,
- 3. Физические свойства. Кальций, подобно щелочным металлам, покрывается
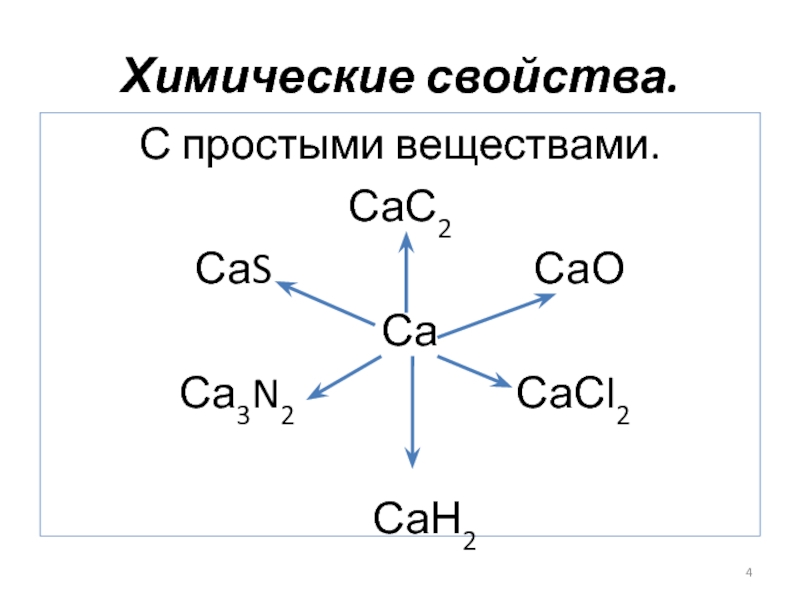
- 4. Химические свойства.С простыми веществами.
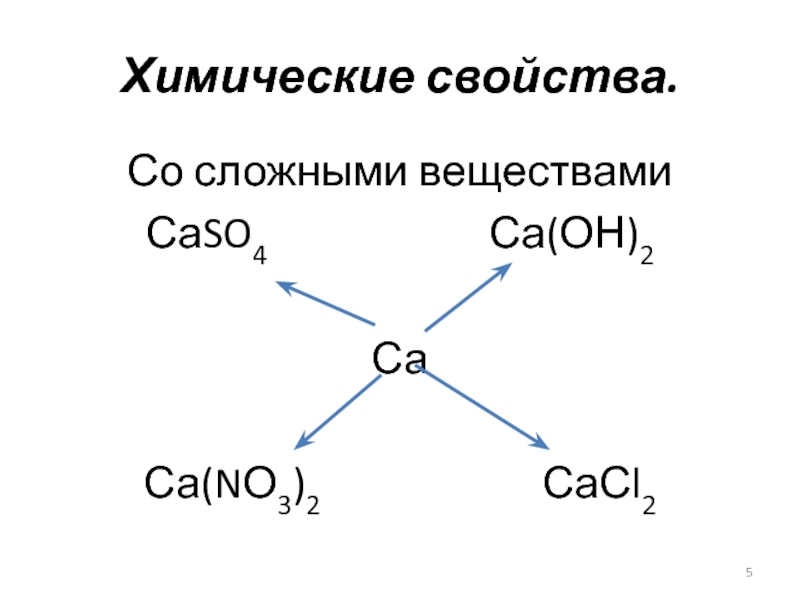
- 5. Со сложными веществамиСаSO4
- 6. Взаимодействие с неметаллами. Са + Н2 →
- 7. Взаимодействие с водой. Са + 2НОН →
- 8. Нахождение в природе. Кальций обладает большой химической
- 9. Получение. Кальций получают путём электролиза его расплавленного
- 10. Оксид кальция – СаО – негашёная
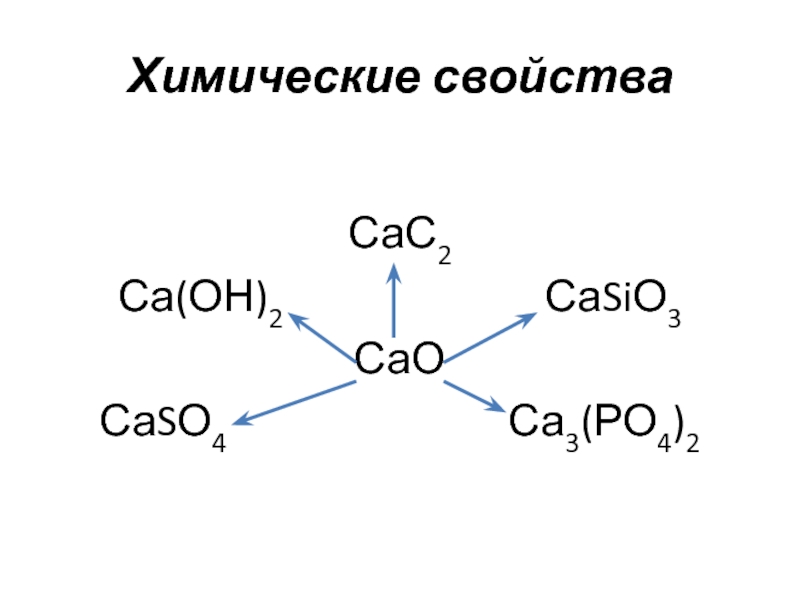
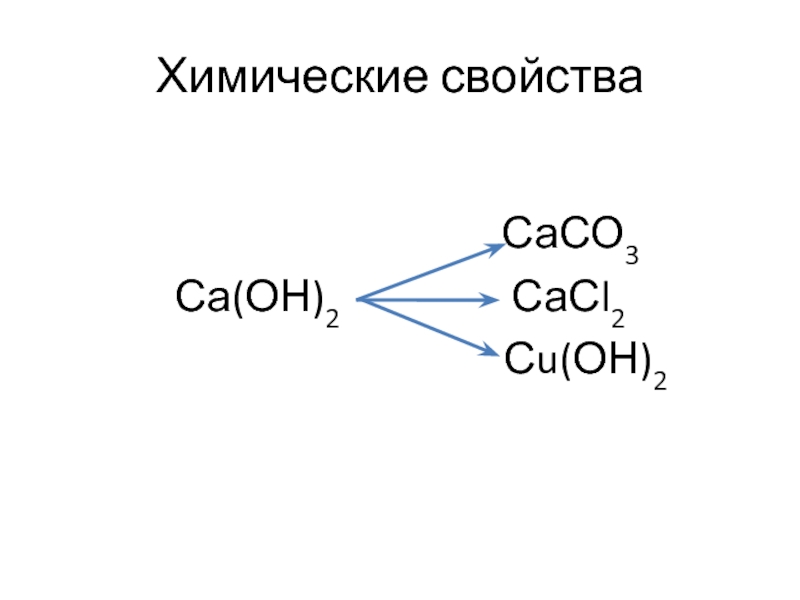
- 11. Химические свойстваСаС2Са(ОН)2
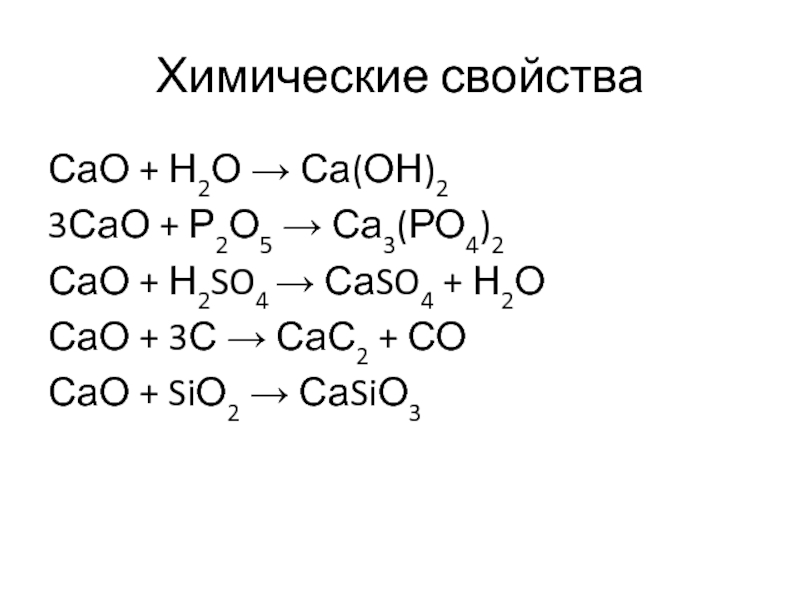
- 12. СаО + Н2О → Са(ОН)23СаО + Р2О5
- 13. Са(ОН)2 – гидроксид кальция, известковая вода,
- 14. Слайд 14
- 15. Са(ОН)2 + СО2 → СаСО3↓ + Н2ОВ
- 16. Качественная реакция на ионы Са2+: Са(ОН)2 + СО2 → СаСО3↓ + Н2ОНаблюдается помутнение известковой воды.
- 17. Гашёная известь – тонкий рыхлый порошок, обычно
- 18. Задание на дом: §§ 32, 33.
Общая характеристика. Кальций – элемент 4 периода, главной подгруппы 2 группы, порядковый номер 20, в ядре атома 20 протонов, 20 нейтронов, 20 электронов. Электронная формула 1s22s22p63s23p64s2, валентные электроны 4s2, поэтому кальций в соединениях 2-х валентен, степени
Слайд 2Общая характеристика.
Кальций – элемент 4 периода, главной подгруппы 2 группы, порядковый
номер 20, в ядре атома 20 протонов, 20 нейтронов, 20 электронов. Электронная формула 1s22s22p63s23p64s2, валентные электроны 4s2, поэтому кальций в соединениях 2-х валентен, степени окисления: 0, +2.
Слайд 3Физические свойства.
Кальций, подобно щелочным металлам, покрывается на воздухе слоем гидроксида, а
поэтому теряет свой блеск. Если поверхность кальция очистить напильником, то оказывается, что это серебристо-белый металл, лёгкий.
ρ = 1,54г/см3, Тпл = 851С.
ρ = 1,54г/см3, Тпл = 851С.
Слайд 6Взаимодействие с неметаллами.
Са + Н2 → СаН2 гидрид кальция
Са + Сl2
→ СаСl2 хлорид кальция
2Са + О2 → 2СаО оксид кальция (негашеная известь)
3Са + N2 → Са3N2 нитрид кальция
Са + 2С → СаС2 карбид кальция
Са + S → СаS сульфид кальция
2Са + О2 → 2СаО оксид кальция (негашеная известь)
3Са + N2 → Са3N2 нитрид кальция
Са + 2С → СаС2 карбид кальция
Са + S → СаS сульфид кальция
Слайд 8Нахождение в природе.
Кальций обладает большой химической активностью, поэтому в природе встречается
только в виде соединений.
СаСО3 – мел, мрамор, известняк.
СаСО3∙ МgСО3 – доломит.
СаSO4∙2Н2О – гипс.
Са3(РО4)2 – фосфорит.
Са5(РО4)3ОН – апатит.
Са5(РО4)3F – фтороапатит.
СаF2 – флюорит.
СаСО3 – мел, мрамор, известняк.
СаСО3∙ МgСО3 – доломит.
СаSO4∙2Н2О – гипс.
Са3(РО4)2 – фосфорит.
Са5(РО4)3ОН – апатит.
Са5(РО4)3F – фтороапатит.
СаF2 – флюорит.
Слайд 9Получение.
Кальций получают путём электролиза его расплавленного хлорида.
СаСl2 ⇄ Са2+ + 2Сl-
На
катоде: На аноде:
Са2+ + 2е → Са0 2Сl- - 2е → Сl2
Суммарная реакция: СаСl2 → Са + Сl2
Са2+ + 2е → Са0 2Сl- - 2е → Сl2
Суммарная реакция: СаСl2 → Са + Сl2
Слайд 10 Оксид кальция – СаО – негашёная известь. Получают его в промышленности
путём обжига известняка:
СаСO3 → СаО + СО2↑
Это тугоплавкое вещество белого цвета, основной оксид, поэтому обладает всеми свойствами присущими основным оксидам.
Слайд 12СаО + Н2О → Са(ОН)2
3СаО + Р2О5 → Са3(РО4)2
СаО + Н2SO4
→ СаSO4 + Н2О
СаО + 3С → СаС2 + СО
СаО + SiО2 → СаSiО3
СаО + 3С → СаС2 + СО
СаО + SiО2 → СаSiО3
Химические свойства
Слайд 13
Са(ОН)2 – гидроксид кальция, известковая вода, гашёная известь.
Получают:
СаО + Н2О
→ Са(ОН)2
Диссоциирует
Са(ОН)2 → Са2+ + 2ОН-
Диссоциирует
Са(ОН)2 → Са2+ + 2ОН-
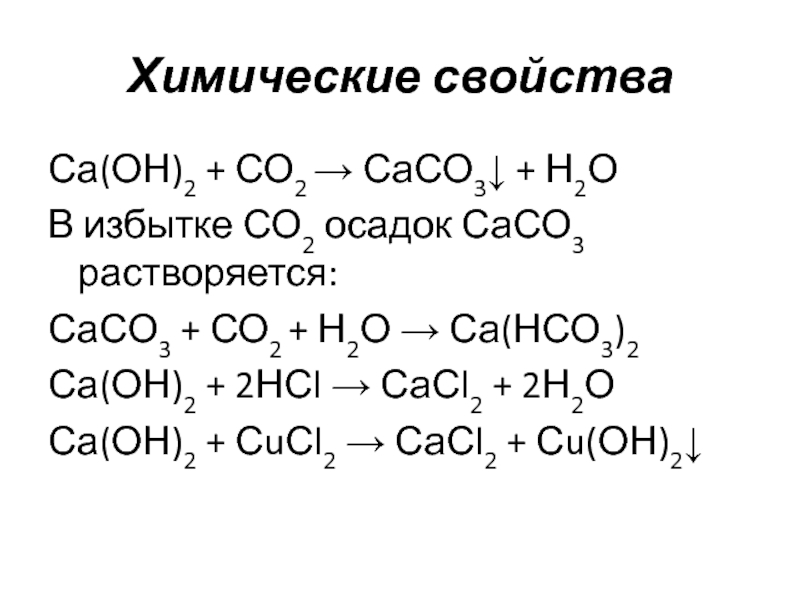
Слайд 15Са(ОН)2 + СО2 → СаСО3↓ + Н2О
В избытке СО2 осадок СаСО3
растворяется:
СаСО3 + СО2 + Н2О → Са(НСО3)2
Са(ОН)2 + 2НСl → СаСl2 + 2Н2О
Са(ОН)2 + СuСl2 → СаСl2 + Сu(ОН)2↓
СаСО3 + СО2 + Н2О → Са(НСО3)2
Са(ОН)2 + 2НСl → СаСl2 + 2Н2О
Са(ОН)2 + СuСl2 → СаСl2 + Сu(ОН)2↓
Химические свойства
Слайд 16
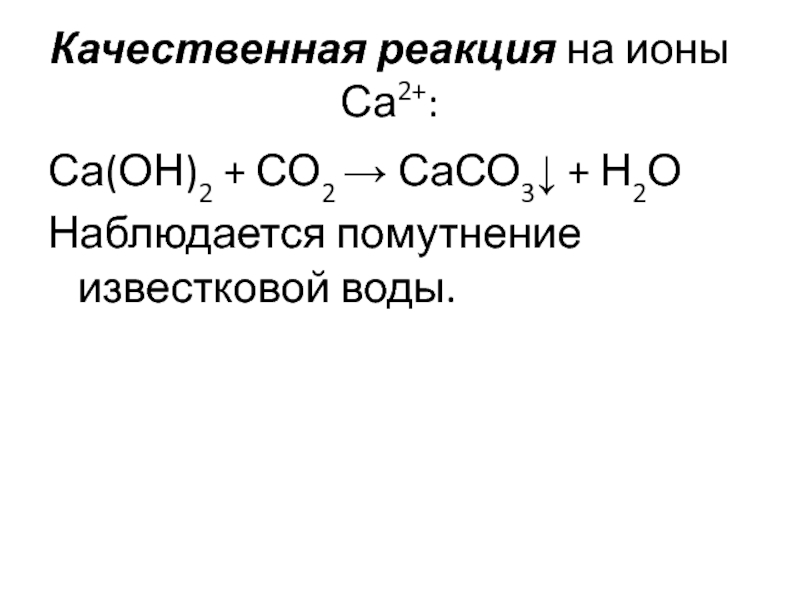
Качественная реакция на ионы Са2+:
Са(ОН)2 + СО2 → СаСО3↓ + Н2О
Наблюдается
помутнение известковой воды.
Слайд 17Гашёная известь – тонкий рыхлый порошок, обычно серого цвета, немного растворим
в воде. Смесь гашёной извести с цементом, водой и песком применяют в строительстве.
Известковое молоко – взвесь, похожая на молоко. Она образуется при смешивании избытка гашёной извести с водой. Применяют его для получения хлорной извести, при производстве сахара и др.
Известковая вода – прозрачный раствор Са(ОН)2, получаемый при фильтровании известкового молока. Используют его в лаборатории для обнаружения углекислого газа.
Известковое молоко – взвесь, похожая на молоко. Она образуется при смешивании избытка гашёной извести с водой. Применяют его для получения хлорной извести, при производстве сахара и др.
Известковая вода – прозрачный раствор Са(ОН)2, получаемый при фильтровании известкового молока. Используют его в лаборатории для обнаружения углекислого газа.