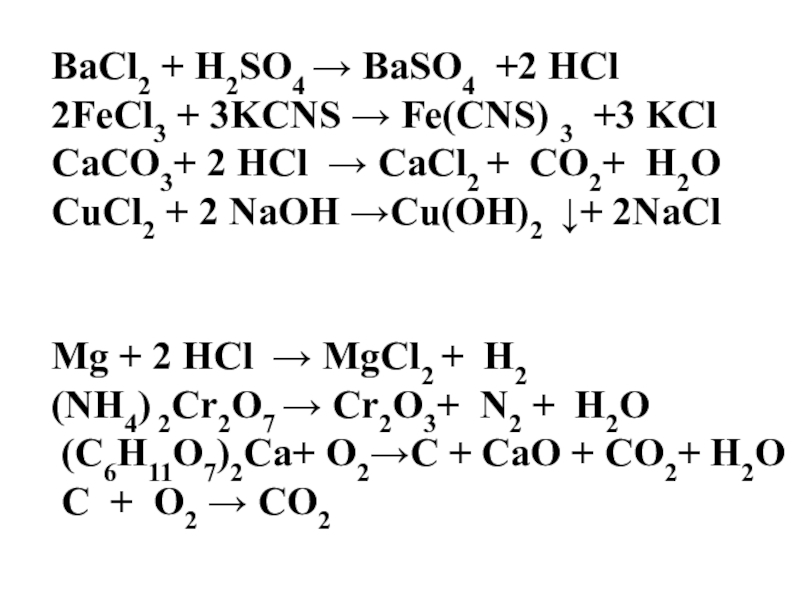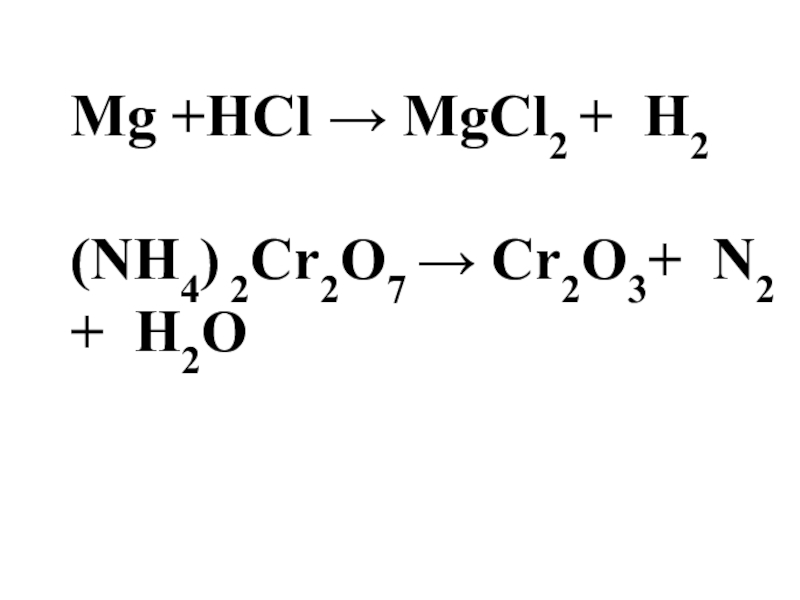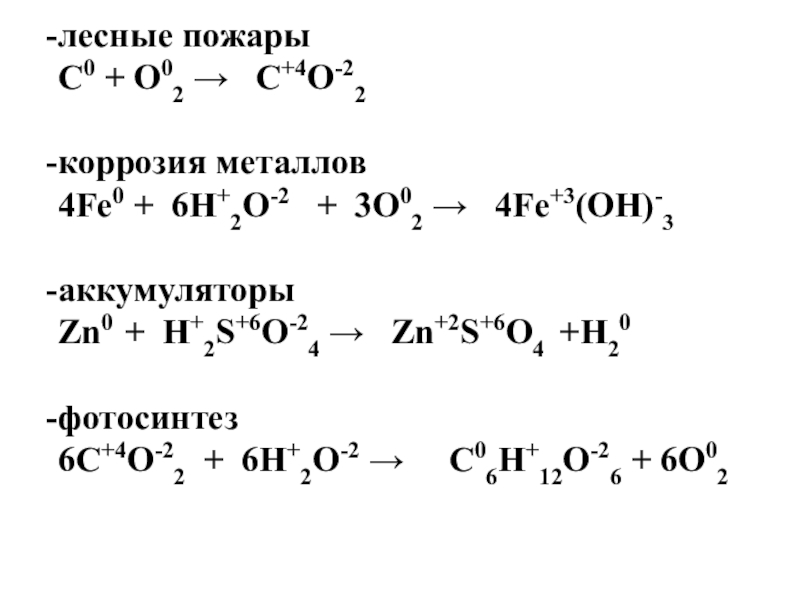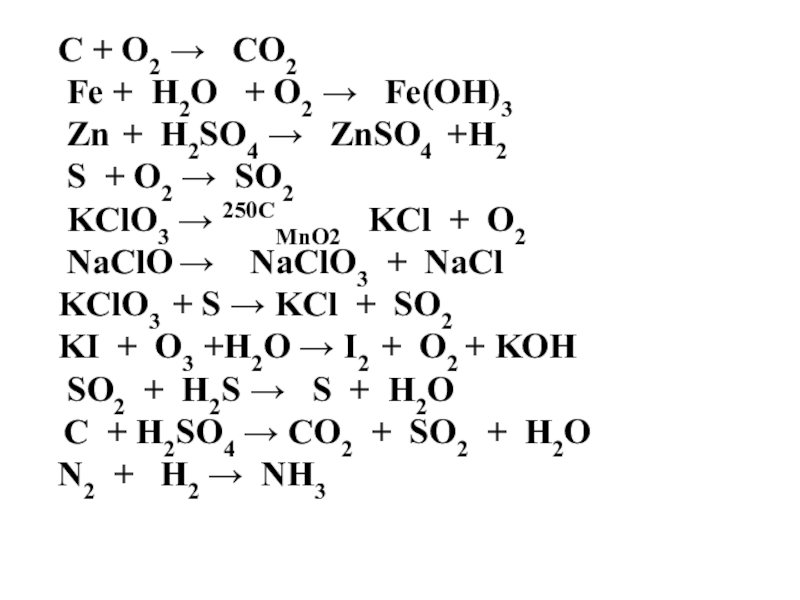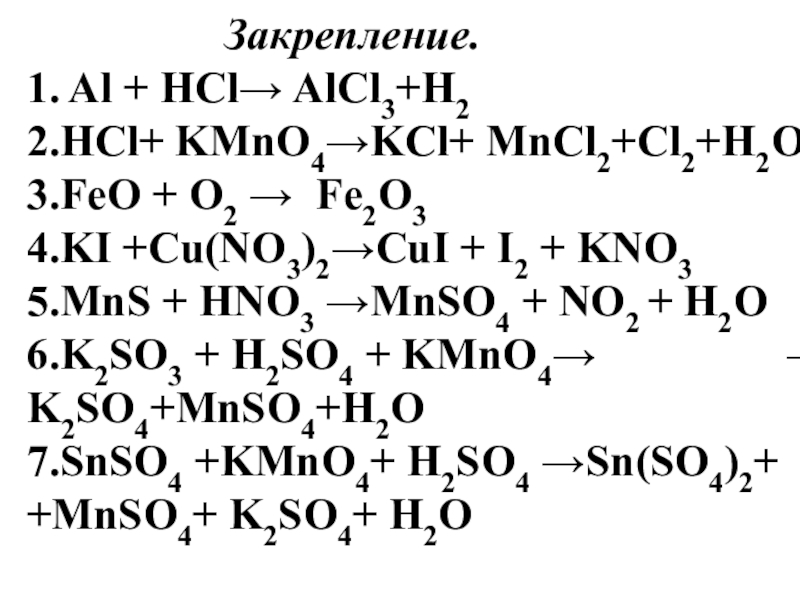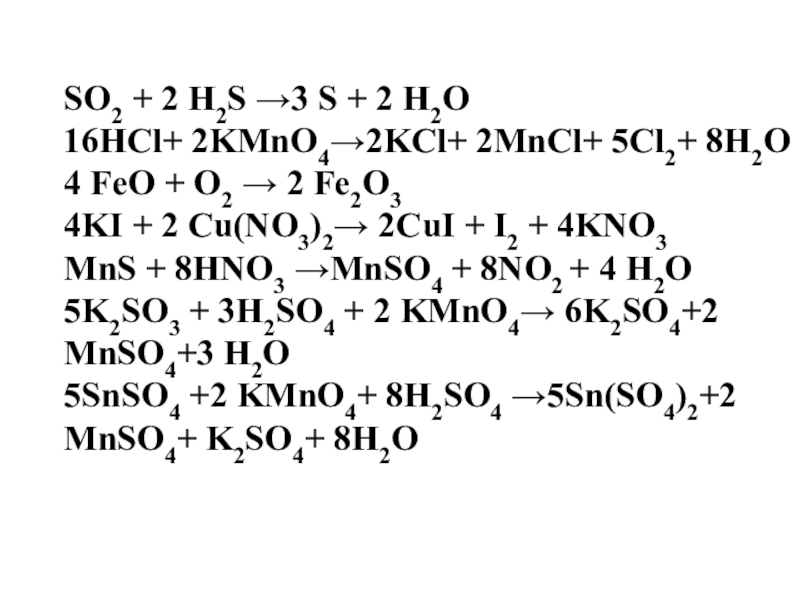3 +3 KCl
CaCO3+ 2 HCl → CaCl2 + CO2+ H2O
CuCl2 + 2 NaOH →Cu(OH)2 ↓+ 2NaCl
Мg + 2 HCl → MgCl2 + H2
(NH4) 2Cr2O7 → Cr2O3+ N2 + H2O
(С6Н11О7)2Са+ O2→С + СаО + CO2+ H2O
C + O2 → CO2
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии ОВР в природе и быту
Содержание
- 1. Презентация по химии ОВР в природе и быту
- 2. Укажите окислительно- восстановительные реакции:1) CaCO3 →CaO +
- 3. Работа в группах над проблемным вопросом:Как по уравнению можно определить окислительно- восстановительную реакцию?
- 4. -По
- 5. Вывод: Окислительно - восстановительную реакцию можно определить
- 6. «Кто-то теряет, а кто-то находит…»«Окислительно-восстановительные реакции в быту и природе.»
- 7. Химические реакции, в результате которых происходит изменение степеней окисления называются окислительно- восстановительными реакциями (ОВР).
- 8. Тест 1) Чему равна низшая степень окисления
- 9. Ответы: 1 – в; 2 – д;
- 10. Процесс отдачи электронов - называется окислением, а
- 11. Метод электронного баланса.В этом методе сравнивают степени
- 12. Алгоритм расстановки коэффициентов в уравнениях окислительно-восстановительных реакций методом электронного баланса.(разработать самостоятельно)
- 13. 1. Запишите схему реакции (формулы исходных веществ
- 14. 5. Расставьте коэффициенты перед формулами восстановителя и
- 15. Мg +HCl → MgCl2 + H2(NH4) 2Cr2O7 → Cr2O3+ N2 + H2O
- 16. Окислительно-восстановительные реакции сопровождают многие процессы, осуществляемые в
- 17. лесные пожары
- 18. -для дыхания С06Н+12О-26 + 6О02 →
- 19. -хлорная известь (хлорка)Cl02 + Ca(OH)2 →
- 20. - отбеливание бумаги, шерсти и шелка
- 21. Физкультминутка
- 22. 1. Упражнения для улучшения мозгового кровообращения «Наклоны головы»Вперед – назадВправо - влево
- 23. 2. Упражнение общего воздействия «Бокс»
- 24. 3. Упражнения для снятия утомления с плечевого пояса и рук «Рывки руками»«Сжимание кисти в кулак»
- 25. 4. Упражнение для снятия напряжения с мышц туловища «Наклоны в сторону»
- 26. «Вращение глазами»по часовой стрелке против часовой стрелки5. Упражнения для глаз
- 27. 6.«Пальчик»Приближайте и отводите палец
- 28. 7. «Моргание»
- 29. 8.Ушные раковины
- 30. Похлопали себе!
- 31. С + О2 → СО2 Fe +
- 32. Уравнять уравнения методом электронного баланса: KClO3 + H2SO4
- 33. Слайд 33
- 34. SО2 + 2 Н2S →3 S +
- 35. Прикоснитесь к науке, экспериментируйте, открывайте новое!
Укажите окислительно- восстановительные реакции:1) CaCO3 →CaO + CO2 2) 2HgО →2Hg + O2 3) Na2O + SO2 → Na2SO3 4) P2O5 + 3H2O → 2H3РO4
Слайд 2Укажите окислительно- восстановительные реакции:
1) CaCO3 →CaO + CO2
2) 2HgО →2Hg
+ O2
3) Na2O + SO2 → Na2SO3
4) P2O5 + 3H2O → 2H3РO4
5) C + O2 → CO2
6) BaCl2 + MgSO4 → BaSO4 + MgCl2
7) Zn + 2HCl → ZnCl2 + H2
8) 3Mg + N2 → Mg3N2
9) Al(NO3)3 + 3HCl → AlCl3 + 3HNO3
10) Fe + CuSO4 → FeSO4 + Cu
3) Na2O + SO2 → Na2SO3
4) P2O5 + 3H2O → 2H3РO4
5) C + O2 → CO2
6) BaCl2 + MgSO4 → BaSO4 + MgCl2
7) Zn + 2HCl → ZnCl2 + H2
8) 3Mg + N2 → Mg3N2
9) Al(NO3)3 + 3HCl → AlCl3 + 3HNO3
10) Fe + CuSO4 → FeSO4 + Cu
Слайд 3Работа в группах над проблемным вопросом:
Как по уравнению можно определить окислительно-
восстановительную реакцию?
Слайд 4
-По изменению степени окисления у
отдельных элементов.
-По наличию хотя бы одного простого вещества.
-По типу химической реакции.
-По наличию хотя бы одного простого вещества.
-По типу химической реакции.
Слайд 5Вывод:
Окислительно - восстановительную реакцию можно определить по изменению степени окисления
у отдельных элементов, по наличию простого вещества и по типу химической реакции.
Слайд 7Химические реакции, в результате которых происходит изменение степеней окисления называются окислительно-
восстановительными реакциями (ОВР).
Слайд 8Тест
1) Чему равна низшая степень окисления серы?
а) –6; б) –4; в)
–2; г) 0; д) +6.
2) Чему равна степень окисления фосфора в соединении Mg3P2? а) +3; б) +5; в) 0; г) –2; д) –3.
3) Какие элементы имеют постоянную степень окисления +1? а) Водород; б) литий; в) медь;
4) Чему равна высшая степень окисления марганца? а) –1; б) 0; в) +7; г) +4; д) +6.
5) Чему равна степень окисления хлора в соединении Са(СlO)2? а) +2; б) +1; в) 0; г) –1; д) –2.
6) Какие из следующих веществ могут являться только окислителями? а) NH3; б) Br2; в) KClO3; г) Fe; д) HNO3.
7) Какие из перечисленных ниже веществ могут быть только восстановителями? Возможно несколько вариантов ответа. а) Н2S; б) KMnO4; в) SO2; г) NH3; д) Na.
2) Чему равна степень окисления фосфора в соединении Mg3P2? а) +3; б) +5; в) 0; г) –2; д) –3.
3) Какие элементы имеют постоянную степень окисления +1? а) Водород; б) литий; в) медь;
4) Чему равна высшая степень окисления марганца? а) –1; б) 0; в) +7; г) +4; д) +6.
5) Чему равна степень окисления хлора в соединении Са(СlO)2? а) +2; б) +1; в) 0; г) –1; д) –2.
6) Какие из следующих веществ могут являться только окислителями? а) NH3; б) Br2; в) KClO3; г) Fe; д) HNO3.
7) Какие из перечисленных ниже веществ могут быть только восстановителями? Возможно несколько вариантов ответа. а) Н2S; б) KMnO4; в) SO2; г) NH3; д) Na.
Слайд 10
Процесс отдачи электронов - называется окислением, а процесс присоединения электронов -
называется восстановлением.
Атомы, которые присоединяют электроны – являются окислителями, а атомы, которые отдают электроны – являются восстановителями.
Отдает - окисляется - восстановитель
Принимает - восстанавливается - окислитель
Атомы, которые присоединяют электроны – являются окислителями, а атомы, которые отдают электроны – являются восстановителями.
Отдает - окисляется - восстановитель
Принимает - восстанавливается - окислитель
Слайд 11Метод электронного баланса.
В этом методе сравнивают степени окисления атомов в исходных
и образующихся веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем.
Слайд 12Алгоритм расстановки коэффициентов в уравнениях окислительно-восстановительных реакций методом электронного баланса.(разработать самостоятельно)
Слайд 131. Запишите схему реакции (формулы исходных веществ и продуктов реакции).
2. Определите
и сравните степени окисления элементов до и после реакции.
3. Подчеркните знаки элементов, степень окисления которых изменилась.
4. Определите окислитель и восстановитель.
3. Подчеркните знаки элементов, степень окисления которых изменилась.
4. Определите окислитель и восстановитель.
Слайд 145. Расставьте коэффициенты перед формулами восстановителя и окислителя методом электронного баланса.
6.
Подберите коэффициенты в правую часть схемы реакции.
7. Устно проверьте правильность составленного уравнения
7. Устно проверьте правильность составленного уравнения
Слайд 16Окислительно-восстановительные реакции сопровождают многие процессы, осуществляемые в промышленности и в различных
сферах быта: горение газа в газовой плите, приготовление пищи, стирка, чистка предметов, изготовление обуви, парфюмерии, фейерверки, отбеливание, дезинфекция, обеззараживание воды, горение, сжигание, дыхание, фотосинтез, получение Ме и Не, производство NH3, HNO3, H2SO4, пластмасс.
Зажигаем ли мы спичку, горят ли в небе причудливые фейерверки – все это окислительно-восстановительные процессы.
Зажигаем ли мы спичку, горят ли в небе причудливые фейерверки – все это окислительно-восстановительные процессы.
Слайд 17лесные пожары
С0
+ О02 → С+4О-22
коррозия металлов
4Fe0 + 6Н+2О-2 + 3О02 → 4Fe+3(OH)-3
аккумуляторы
Zn0 + H+2S+6O-24 → Zn+2S+6О4 +H20
фотосинтез
6С+4О-22 + 6Н+2О-2 → С06Н+12О-26 + 6О02
коррозия металлов
4Fe0 + 6Н+2О-2 + 3О02 → 4Fe+3(OH)-3
аккумуляторы
Zn0 + H+2S+6O-24 → Zn+2S+6О4 +H20
фотосинтез
6С+4О-22 + 6Н+2О-2 → С06Н+12О-26 + 6О02
Слайд 18-для дыхания
С06Н+12О-26 + 6О02 → 6С+4О-22 + 6Н+2О-2 +
2875кДж
извержение вулкана
S + O2 → SO2
-для получения кислорода
2K+Cl+5O-23 → 250CMnO2 2K+Cl- + 3О02
без катализатора
4KCl+5O3 → 600C KCI- + 3K+Cl+7O-24 -
извержение вулкана
S + O2 → SO2
-для получения кислорода
2K+Cl+5O-23 → 250CMnO2 2K+Cl- + 3О02
без катализатора
4KCl+5O3 → 600C KCI- + 3K+Cl+7O-24 -
Слайд 19 -хлорная известь (хлорка)
Cl02 + Ca(OH)2 → OC Ca+2Cl-(Cl+O-2)- + H2O
в качестве отбеливателя
3Na+Cl+O-2 → Na+Cl+5O-23 + 2Na+Cl-
-взрывчатые вещества
2K+Cl+5O-23 + 3S0 → 2K+Cl- + 3S+4О-22
-качественная реакция на озон
2K+I- + О03 +Н+2О-2 → I02 + O02 + K+O-2H+
Слайд 20 - отбеливание бумаги, шерсти и шелка
S+4O-22 + 2H+2S-2 →
3S0 + 2Н2О
SO2- убивает бактерии, окуривают овощехранилище, используют при консервировании.
C0 + 2H2S+6O4 → C+4O2 + 2S+4O2 + 2Н2О
- получение спирта брожением из глюкозы С06Н+12О-26 → 2С-42Н+5О-2Н+ + 2С+4О2
получение аммиака NH3
N2 + 3H2 → 2 NH3
SO2- убивает бактерии, окуривают овощехранилище, используют при консервировании.
C0 + 2H2S+6O4 → C+4O2 + 2S+4O2 + 2Н2О
- получение спирта брожением из глюкозы С06Н+12О-26 → 2С-42Н+5О-2Н+ + 2С+4О2
получение аммиака NH3
N2 + 3H2 → 2 NH3
Слайд 221. Упражнения для улучшения мозгового кровообращения
«Наклоны головы»
Вперед – назад
Вправо -
влево
Слайд 243. Упражнения для снятия утомления
с плечевого пояса и рук
«Рывки
руками»
«Сжимание
кисти в кулак»
Слайд 29
8.Ушные раковины имеют активные точки, связанные с
внутренним органами.
Энергично потрем мочки наших ушек.
Энергично потрем мочки наших ушек.
Слайд 31С + О2 → СО2
Fe + Н2О + О2
→ Fe(OH)3
Zn + H2SO4 → ZnSО4 +H2
S + O2 → SO2
KClO3 → 250CMnO2 KCl + О2
NaClO → NaClO3 + NaCl
KClO3 + S → KCl + SО2
KI + О3 +Н2О → I2 + O2 + KOH
SO2 + H2S → S + Н2О
C + H2SO4 → CO2 + SO2 + Н2О
N2 + H2 → NH3
Zn + H2SO4 → ZnSО4 +H2
S + O2 → SO2
KClO3 → 250CMnO2 KCl + О2
NaClO → NaClO3 + NaCl
KClO3 + S → KCl + SО2
KI + О3 +Н2О → I2 + O2 + KOH
SO2 + H2S → S + Н2О
C + H2SO4 → CO2 + SO2 + Н2О
N2 + H2 → NH3
Слайд 32Уравнять уравнения методом электронного баланса:
KClO3 + H2SO4 →ClO2 + KClO4
+ KHSO4 + H2O
SO2 + KMnO4 + H2O → MnSO4 + K2SO4 + H2SO4
NH3 + KMnO4 + H2O → t N2 + MnO2 + KOH
С6Н12О6 + KMnO4 + H2SO4 → CO2 + MnSO4 + K2SO4 + H2O
SO2 + KMnO4 + H2O → MnSO4 + K2SO4 + H2SO4
NH3 + KMnO4 + H2O → t N2 + MnO2 + KOH
С6Н12О6 + KMnO4 + H2SO4 → CO2 + MnSO4 + K2SO4 + H2O
Слайд 33
Закрепление.
1. Al + HCl→ AlCl3+H2
2.HCl+ KMnO4→KCl+ MnCl2+Cl2+H2O
3.FeO + O2 → Fe2O3
4.KI +Cu(NO3)2→CuI + I2 + KNO3
5.MnS + HNO3 →MnSO4 + NO2 + H2O 6.K2SO3 + H2SO4 + KMnO4→ → K2SO4+MnSO4+H2O
7.SnSO4 +KMnO4+ H2SO4 →Sn(SO4)2+ +MnSO4+ K2SO4+ H2O
1. Al + HCl→ AlCl3+H2
2.HCl+ KMnO4→KCl+ MnCl2+Cl2+H2O
3.FeO + O2 → Fe2O3
4.KI +Cu(NO3)2→CuI + I2 + KNO3
5.MnS + HNO3 →MnSO4 + NO2 + H2O 6.K2SO3 + H2SO4 + KMnO4→ → K2SO4+MnSO4+H2O
7.SnSO4 +KMnO4+ H2SO4 →Sn(SO4)2+ +MnSO4+ K2SO4+ H2O
Слайд 34SО2 + 2 Н2S →3 S + 2 Н2О
16HCl+ 2KMnO4→2KCl+
2MnCl+ 5Cl2+ 8H2O
4 FeO + O2 → 2 Fe2O3
4KI + 2 Cu(NO3)2→ 2CuI + I2 + 4KNO3
MnS + 8HNO3 →MnSO4 + 8NO2 + 4 H2O
5K2SO3 + 3H2SO4 + 2 KMnO4→ 6K2SO4+2 MnSO4+3 H2O
5SnSO4 +2 KMnO4+ 8H2SO4 →5Sn(SO4)2+2 MnSO4+ K2SO4+ 8H2O
4 FeO + O2 → 2 Fe2O3
4KI + 2 Cu(NO3)2→ 2CuI + I2 + 4KNO3
MnS + 8HNO3 →MnSO4 + 8NO2 + 4 H2O
5K2SO3 + 3H2SO4 + 2 KMnO4→ 6K2SO4+2 MnSO4+3 H2O
5SnSO4 +2 KMnO4+ 8H2SO4 →5Sn(SO4)2+2 MnSO4+ K2SO4+ 8H2O