- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме: Изомерия и номенклатура спиртов (10 класс)
Содержание
- 1. Презентация по теме: Изомерия и номенклатура спиртов (10 класс)
- 2. Слайд 2
- 3. ЦелеполаганиеО чем пойдет речь сегодня на уроке?С
- 4. При сжигании органического вещества массой 0,46 г, было
- 5. 1. Молярную массу вещества вычисляем по
- 6. КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
- 7. Вещества мы не простыеИ известны с древних
- 8. Спирты
- 9. Задачи:Определить состав и строение спиртов;Познакомиться с
- 10. С2Н6О Н НН-С- С- О-Н
- 11. Слайд 11
- 12. С2Н6О
- 13. Строение
- 14. ? Почему спирты называют ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ
- 15. Гомологический ряд предельных многоатомных спиртов
- 16. Номенклатура При образовании названий спиртов к названию
- 17. Основные принципы номенклатуры спиртов: Выбирают самую длинную
- 18. Назовите вещества формулы которых:
- 19. Классификация спиртов
- 20. Классификация спиртов по углеводородному радикалуПредельные спиртыH3C -
- 21. Классификация по числу гидроксильных группОдноатомныеCH3 – CH
- 22. По характеру атома углерода ПервичныеCH3 - CH2
- 23. Изомерия
- 24. Изомерия по углеродному скелетуH3C - CH2
- 25. Изомерия по положению функциональной группыCH2 – CH2
- 26. Межклассовая изомерияПредельные одноатомные спирты являются изомерами простых
- 27. Физические свойстваНизшие спирты летучие жидкости с резким
- 28. Следствием полярности связи :О
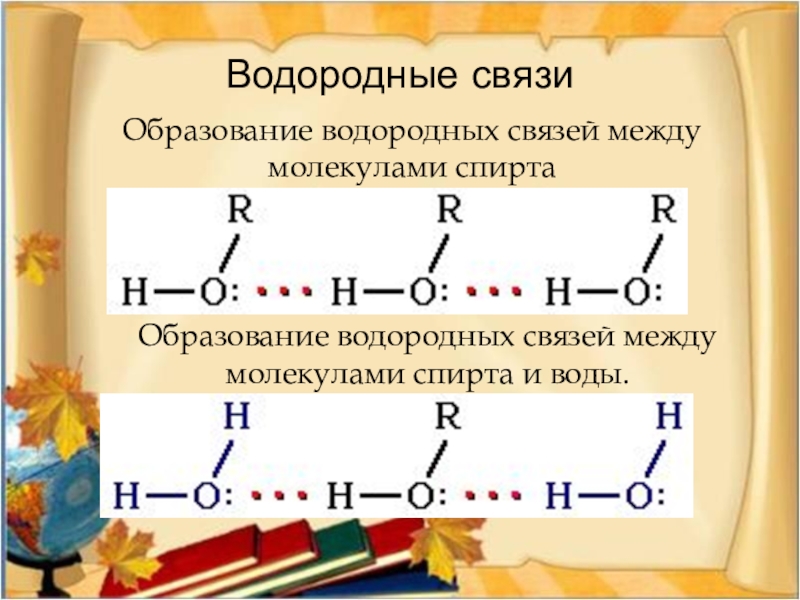
- 29. Водородные связиОбразование водородных связей между молекулами спиртаОбразование водородных связей между молекулами спирта и воды.
- 30. Химический эксперимент
- 31. Применение
- 32. Физиологическое действие
- 33. Слайд 33
- 34. Слайд 34
- 35. Слайд 35
- 36. Если в трезвом состоянии снайпер 10 патронами
- 37. «Вино губит телесное здоровье людей, губит
- 38. Закрепление
- 39. Домашнее задание Прочитать § 9 стр
- 40. Ответы1- 3; 2- 2; 3- 3; 4-
- 41. РефлексияРазрешили ли вы проблему, поставленную в начале
- 42. «Вино сообщает каждому, кто пьёт,
Слайд 3Целеполагание
О чем пойдет речь сегодня на уроке?
С чем связано такое поведение
Какую проблему вы увидели в данной теме?
Слайд 4При сжигании органического вещества массой 0,46 г, было получено 0,8г
оксида углерода (IV) и 0,54
Слайд 5
1. Молярную массу вещества вычисляем по его плотности по водороду:
М (в-ва)
2. Найдем количество вещества углерода и водорода в веществе:
n(СО2) = m / М = 0,88 г / 44г/моль = 0,02 моль
n(С) = n(СО2) = 0,02 моль
n(Н2О) = m / M = 0,54 г / 18г/моль = 0,03 моль
n(Н) = 2 ∙ n(Н2О) = 2 ∙ 0,03 моль = 0,06 моль
3. Определим массу кислорода в веществе:
m(O) = m(в-ва) – (m(С) + m(Н))
m(C) = 12г/ моль . 0,02 моль = 0,24 г
m(H) = 1 г/ моль ∙ 0,06 моль =0,06 г
M(O) = 0,46 г – (0,24 г + 0,06 г) = 0,16 г
4. Вычислим количества вещества атома кислорода:
ν(О) = m/M = 0,16/16 = 0,01 моль
5. Найдем отношение индексов х:y:z
х:y:z = ν(C) : ν(Н) : ν(O) = 0,02 : 0,06 : 0,01 = 2: 6 : 1
Простейшая формула вещества С2Н6О
6. Определим истинную формулу вещества.
Молярная масса простейшей формулы:
М(С2Н6О) = 12 · 2 + 1 ∙ 6 + 16 · 1 = 46г/моль
Следовательно, найденная эмпирическая формула вещества является истинной.
Ответ: С2Н6О.
Слайд 7Вещества мы не простые
И известны с древних пор.
В медицине применимы:
Дать инфекции
По свойствам мы не так просты.
А называемся …
Слайд 9 Задачи:
Определить состав и строение спиртов;
Познакомиться с классификацией спиртов;
Изучить гомологи и
Физические свойства;
Влияние спиртов на организм человека.
Слайд 13
Строение
Спиртами называются органические вещества,
Общая формула предельных одноатомных спиртов CnH2n+1OН или R- OH
.
Слайд 16Номенклатура
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют
Цифрами после суффикса, указывают положение гидроксильной группы в главной цепи.
Префиксами ди–, три-, тетра- и т.д. –число гидроксильных групп.
Слайд 17Основные принципы номенклатуры спиртов:
Выбирают самую длинную углеродную цепь и нумеруют
Называют заместители в основной углеродной цепи и цифрами указывают их положения.
Называют основную цепь как алкан и добавляют суффикс –ол.
Цифрой указывают положение ОН-группы.
Слайд 18Назовите вещества формулы которых:
а) СН3– СН2– СН
СН2– СН2—
у.в радикал предельный соединенный с одной группой ОН
1
2
3
4
5
-метил
5
пентан
ОН
ол
ОН
-
б) СН3– СН2– СН –СН– СН3
СН3
1
5
3
4
2
3
-метил
5
пентан
ОН
ОН
ол-
Слайд 20Классификация спиртов по углеводородному радикалу
Предельные спирты
H3C - CH2 – CH2 -
Непредельные спирты
H3C - CH = CH - CH2 - OH
Ароматические спирты
CH2 -OH
Слайд 21Классификация по числу гидроксильных групп
Одноатомные
CH3 – CH – CH2 – CH3
Двухатомные
CH3 – CH – CH –CH3
OH OH
Трехатомные
CH2 – CH – CH –CH3
OH OH OH
Слайд 22По характеру атома углерода
Первичные
CH3 - CH2 - OH
CH3 – CH – CH2 – CH3
OH
Третичные
CH3
H3C – C - OH
CH3
Слайд 24Изомерия по углеродному
скелету
H3C - CH2 –CH2 - CH2 -OH
бутанол-1
H3C –
CH3
2-метилпропанол-1
Слайд 25Изомерия по положению функциональной группы
CH2 – CH2 – CH2 – CH2
OH
пентанол-1
CH2 – CH2 – CH2 – CH2 –CH3
OH
пентанол-2
CH2 – CH2 – CH2 – CH2 –CH3
OH
пентанол-3
Слайд 26Межклассовая изомерия
Предельные одноатомные спирты являются изомерами простых эфиров
CH3- CH2- OH
этанол
CH3-
диметиловый эфир
C2 H6O
Слайд 27Физические свойства
Низшие спирты летучие жидкости с резким запахом.
Высшие спирты кристаллические вещества
При растворение спиртов в воде происходит образование водородных связей между молекулами спирта и молекулами воды.
Слайд 28 Следствием полярности связи :О Н и наличия
Слайд 29Водородные связи
Образование водородных связей между молекулами спирта
Образование водородных связей между молекулами
Слайд 36Если в трезвом состоянии снайпер 10 патронами выбивает 96 очков из
Производительность труда наборщиков, секретарей – референтов снижается на 25%, а число ошибок увеличивается на 30%.
Вино губит …
Слайд 37
«Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние
Л.Н. Толстой
Слайд 39Домашнее задание
Прочитать § 9 стр 63 -68. творческая работа
Слайд 41Рефлексия
Разрешили ли вы проблему, поставленную в начале урока?
Как вы можете
Изменилось ли ваше отношение к проблеме поднятой в фильме?
Алкоголь — это социальное зло
Слайд 42
«Вино сообщает каждому, кто пьёт,
четыре качества: сначала павлина,
Абу-ль-Фарадж