- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме: Атом. Строение. 8 класс
Содержание
- 1. Презентация по теме: Атом. Строение. 8 класс
- 2. ZnO NaCl m=M * n Путешествие по
- 3. Строение атомаэлектроныядропротонынейтроны1-внутреняя сфера, в которой находится ядро122-внешняя сфера, на которой находятся электроныпримерпутешествие по химии
- 4. +8 o(8p+ + 8n0) 8e-1)Число протонов и
- 5. 5 формул строения атомаОпределение числа протонов, электронов
- 6. пример2Строение атома Si14р+; 14е-; 14n02) +14
- 7. Строение атома O 8р+; 8е- ; 8n0+8 )2 )41S2 2S2 2P4 5)путешествие по химии zху
- 8. Распределение электронов по энергетическим уровням+N=1N=2N=3N=4N=5N=6N=7ЭНЕРГИЯ Е УВЕЛИЧИВАЕТСЯпутешествие по химии
- 9. Количество электронов на энергетических уровнях++…2e8e18е32е32еN=1N=2N=3N=4N=5N=2n2путешествие по химии
- 10. Движение электрона вокруг ядра+путешествие по химии
- 11. путешествие по химии Уровни энергий атомных орбиталей6d5f7s6p5d4f6s5p4d5s4p3d4s3p3s2p2s1sS
- 12. Правила распределения электронов по энергетическим уровням1.Сначала полностью
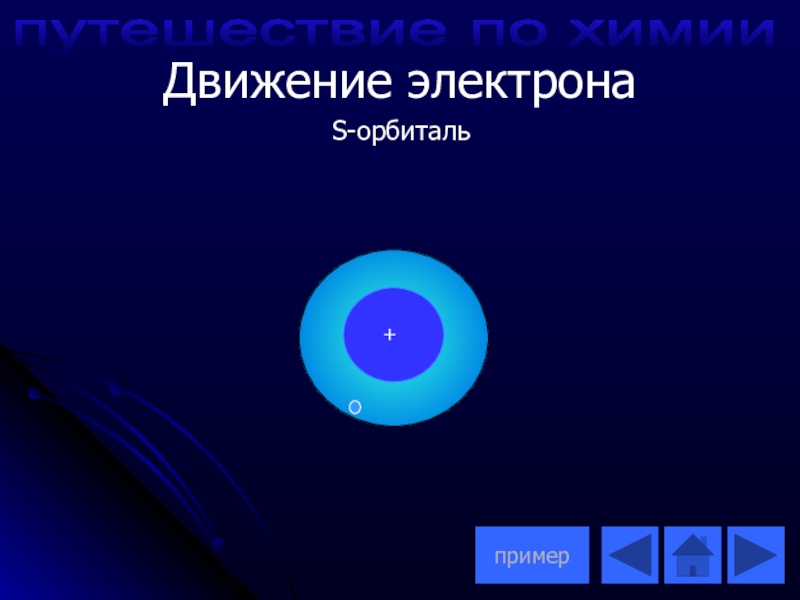
- 13. S-орбиталь+Движение электрона примерпутешествие по химии
- 14. +2 He ) 2 1 S2 Пример движения электрона по S-орбитали+путешествие по химии
- 15. Движение электронаР - орбиталь+zхупримерпутешествие по химии
- 16. +13 Al ) ) ) 2
- 17. Агрегатные состояния реагирующих веществ1) Реакции в растворах
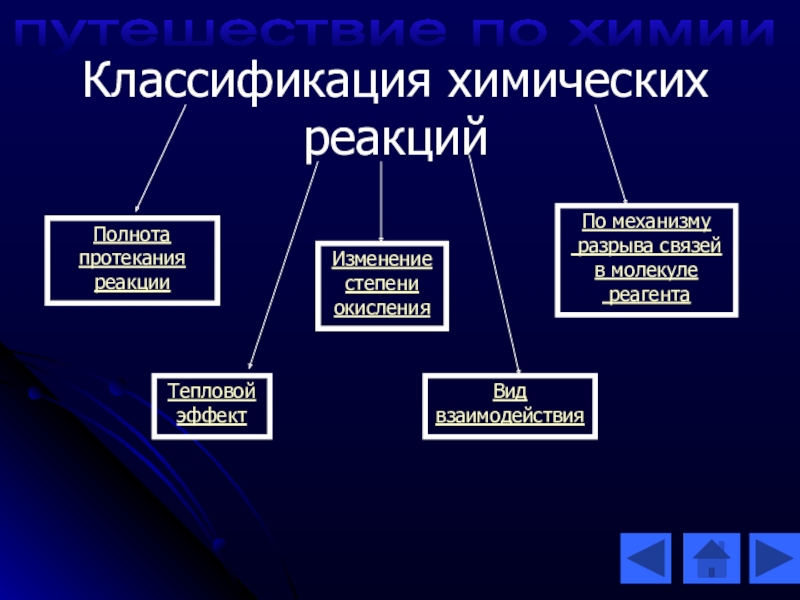
- 18. Классификация химических реакцийВид взаимодействияИзменение степени окисленияТепловой эффектПо механизму разрыва связей в молекуле реагентаПолнотапротеканияреакциипутешествие по химии
- 19. Вид взаимодействия1) Реакции разложения – реакции, в
- 20. Изменение степени окисления1) Реакции, протекающие без изменения
- 21. Ba + 2HCl = BaCl2 + H20
- 22. Механизм разрыва связей в молекуле реагента1) Гомолитические
- 23. Тепловой эффект1) Экзотермические реакции – реакции, протекающие
- 24. Полнота протекания реакции1) Обратимые реакции – реакции,
Слайд 2ZnO
NaCl
m=M * n
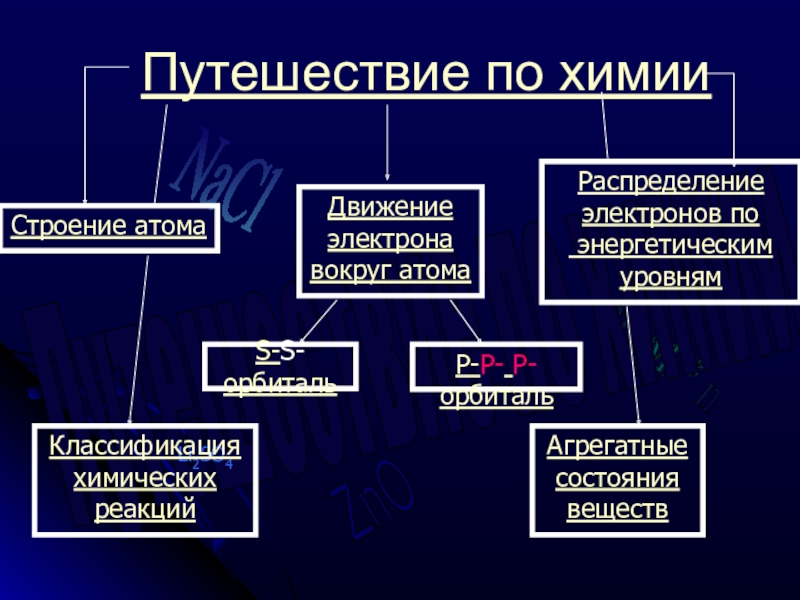
Путешествие по химии
Путешествие по химии
Строение
Движение электрона вокруг атома
S-S-орбиталь
P-P- P- орбиталь
Li2SO4
Классификация
химических
реакций
Агрегатные
состояния
веществ
Распределение
электронов по
энергетическим
уровням
Слайд 3Строение атома
электроны
ядро
протоны
нейтроны
1-внутреняя сфера, в которой находится ядро
1
2
2-внешняя сфера, на которой находятся
пример
путешествие по химии
Слайд 4+8 o
(8p+ + 8n0) 8e-
1)Число протонов и электронов равны порядковому номеру
2) Что бы найти число нейтронов, нужно из молекулярной массы
элемента вычесть массу протонов или электронов.
У кислорода порядковый номер равен 8, поэтому
число электронов и протонов равны 8. А молекулярная масса кислорода равна 16,
поэтому чтобы найти число нейтронов надо из16(молекулярной массы кислорода)
вычесть заряд ядра(или число протонов или число электронов).
Строения атома на примере О
путешествие по химии
Слайд 55 формул строения атома
Определение числа протонов, электронов и нейтронов у элемента
Распределение
Электронная формула элемента
Ячеечное строение элемента
Графическое изображение электронов, находящихся на внешнем
энергетическом уровне.
пример
путешествие по химии
Слайд 6
пример2
Строение атома Si
14р+; 14е-; 14n0
2) +14 )2 )8 )4
3)
4)
5)
путешествие по химии
z
х
у
Слайд 8Распределение электронов по энергетическим уровням
+
N=1
N=2
N=3
N=4
N=5
N=6
N=7
ЭНЕРГИЯ Е УВЕЛИЧИВАЕТСЯ
путешествие по химии
Слайд 9Количество электронов на энергетических уровнях
+
+
…
2e
8e
18е
32е
32е
N=1
N=2
N=3
N=4
N=5
N=2n2
путешествие по химии
Слайд 11путешествие по химии
Уровни энергий атомных орбиталей
6d
5f
7s
6p
5d
4f
6s
5p
4d
5s
4p
3d
4s
3p
3s
2p
2s
1s
S
Слайд 12Правила распределения электронов по энергетическим уровням
1.Сначала полностью заполняют подуровень с более
2.При заполнении подуровня с несколькими орбиталями сначала заполняют все орбитали электронами с одним спином и только затем добавляют на каждую орбиталь по второму электрону с противоположным спином.
путешествие по химии
Слайд 16
+13 Al ) ) )
2 8 3
_
3 S2 3 P1
+
путешествие
Пример движения электрона по
Р-орбитали
z
х
у
Слайд 17Агрегатные состояния реагирующих веществ
1) Реакции в растворах ( жидкофазные ):
2) Газовые реакции ( газофазные ):
N2 + O2 = 2 NO
3) Реакции между твердыми веществами ( твердофазные ) :
CaO + 3C = CaC2 + CO
путешествие по химии
Слайд 18Классификация химических реакций
Вид
взаимодействия
Изменение
степени
окисления
Тепловой
эффект
По механизму
разрыва связей
в
реагента
Полнота
протекания
реакции
путешествие по химии
Слайд 19Вид взаимодействия
1) Реакции разложения – реакции, в ходе которой из одного
получается несколько других, например:
2H2O2 = 2H2O + O2
2KCl + O2
t,Mno2
KClO3
2) Реакции соединения – реакции, в ходе которой из нескольких веществ
Получается одно, более сложного состава, например:
NH3 + HCl = NH4Cl 4P + 5O2 = 2P2O5
3) Реакции обмена – реакции, в ходе которой реагенты обмениваются
составными частями молекул, например:
AgNO3 + HCl = AgCl + HNO3 K2SO4 + BaCl2 = BaSO4 + 2KCl
4) Реакции замещения – реакции, в ходе которой простое вещество
взаимодействует со сложным с образованием другого простого и другого
сложного веществ, например:
Zn + CuSO4 = ZnSO4 + Cu 2Al + 2NH3 = 2AlN + 3H2
путешествие по химии
Слайд 20Изменение степени окисления
1) Реакции, протекающие без изменения степеней окисления реагентов,
например:
Na2CO3 + H2SO4 = Na2SO4 + CO2 +H2O
2) Окислительно – восстановительные реакции – реакции, в ходе которой
изменяются степени окисления атомов хотя бы одного элемента, например:
Ba + 2HCl = BaCl2 + H2
4HNO3 2H2O + 4NO2 + O2
0 +1 +2 0
+1 +5 -2 +1 -2 +4 -2 0
путешествие по химии
Слайд 21Ba + 2HCl = BaCl2 + H2
0
Пример окислительно - восстановительной реакции
Ba0 Ba +2
-2e
2H+1 H2 0
+2e
путешествие по химии
Слайд 22Механизм разрыва связей в молекуле реагента
1) Гомолитические реакции – при гомолитическом
электронная пара делится между атомами с образованием радикалов – частиц,
имеющих неспаренные электроны, например :
Cl:Cl 2Cl.
2) Гетеролитические реакции – сопровождаются гетеролитическим
разрывом связи, при котором электронная пара остается на одном из атомов
(он становится анионом). А оставшаяся часть молекулы становится катионом ,
например :
CH3Cl CH3+ + : Cl-
путешествие по химии
Слайд 23Тепловой эффект
1) Экзотермические реакции – реакции, протекающие с выделением теплоты,
например :
C + O2 = CO2 + Q
2) Эндотермические реакции – реакции, протекающие с поглощением теплоты,
например :
2 HgO 2Hg + O2 - Q
путешествие по химии
Слайд 24Полнота протекания реакции
1) Обратимые реакции – реакции, которые протекают одновременно в
противоположных направлениях.
NH3 + H2O NH4OH
N2 + 3H2 2NH3
2) Необратимые реакции – реакции, которые идут практически в одном
направлении.
AgNO3 + HCl = AgCl + HNO3
2NaHCO3 Na2CO3 + CO2 + H2O
путешествие по химии