- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по органической химии Химические свойства карбоновых кислот
Содержание
- 1. Презентация по органической химии Химические свойства карбоновых кислот
- 2. Узнаете, чем органические кислоты похожи на неорганические,
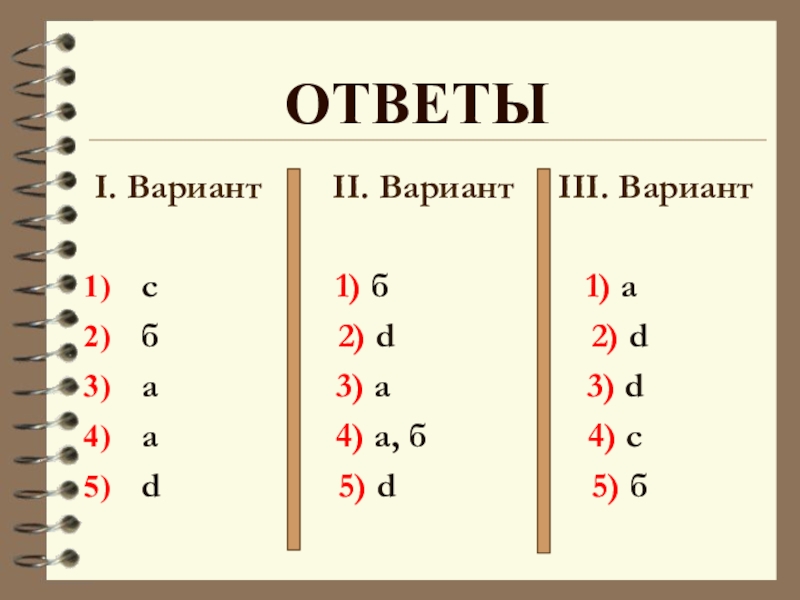
- 3. I. Вариант II. Вариант
- 4. молочная кислота
- 5. лимонная кислота
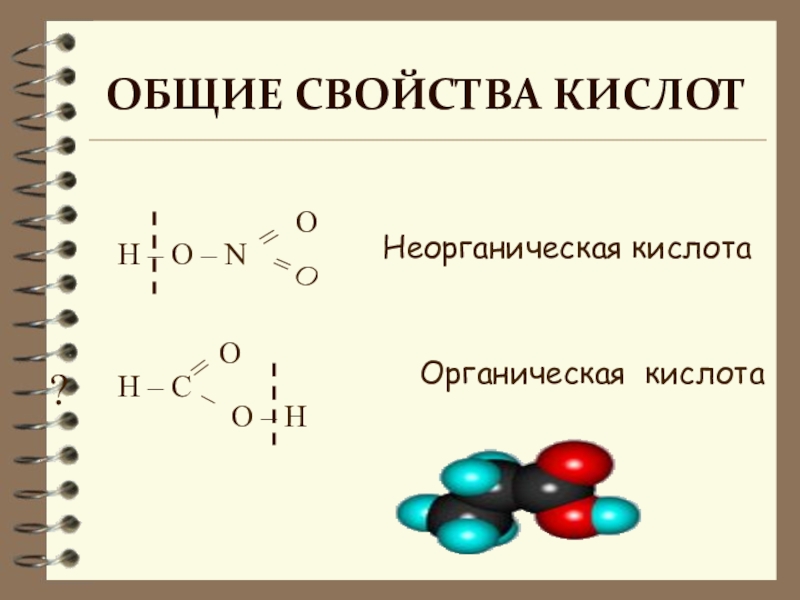
- 6. Вспомните, какие химические свойства характерны для кислотфиз
- 7. H – O – NO – H ?Неорганическая кислотаОрганическая кислотаОбщие свойства кислот
- 8. I. Реакции с разрывом связи О-Н
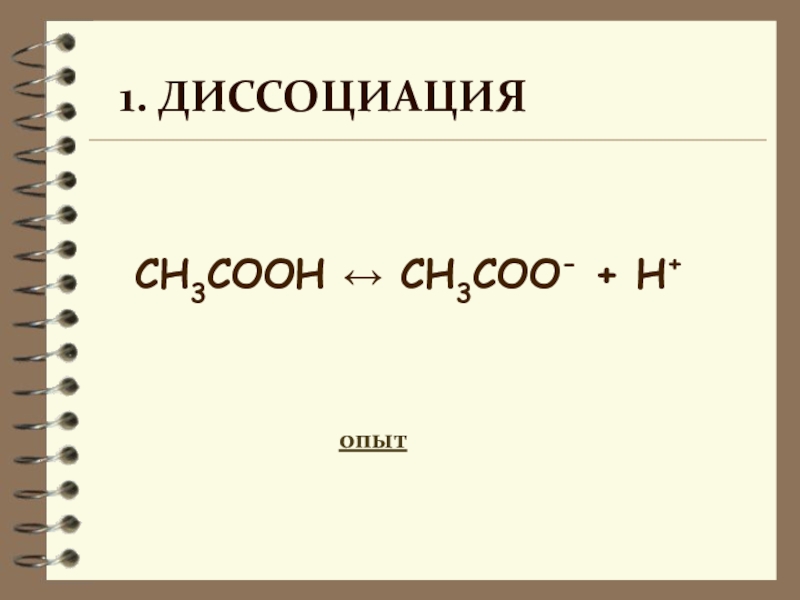
- 9. СН3COOH ↔ СН3COO- + H+ 1. Диссоциацияопыт
- 10. 2СН3–СООН + Zn = (СН3СОО)2Zn + H2
- 11. R–COOH + MeО → R–COOMe + H2О2СН3–СООН
- 12. R–COOH + MeОН → R–COOMe + H2ОСН3СООН
- 13. 5. Взаимодействие с солями.R–COOH + соль →
- 14. II. Реакции с разрывом связи С-О(замещение группы
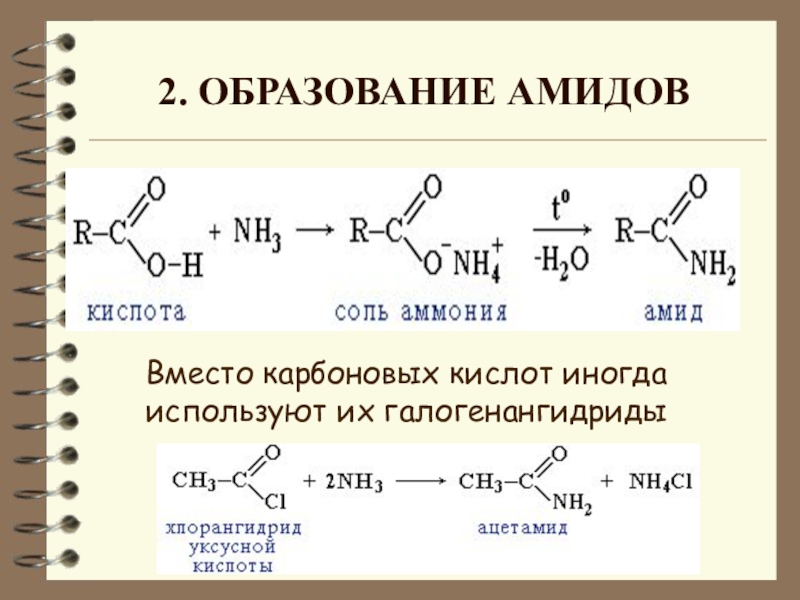
- 15. Вместо карбоновых кислот иногда используют их галогенангидриды 2. Образование амидов
- 16. 1. ГалогенированиеIII. Реакции с разрывом связей С-Н (реакции с участием радикала)
- 17. Разложение при нагреванииСпецифические реакции муравьиной кислоты
- 18. Муравьиная кислота НСООНДифункциональное соединение – кислота
- 19. Проверь свои знания по карбоновым кислотамСоставьте уравнения химических реакцийПрезентация 1Презентация 2Выполни тест
- 20. 1. Уксусная кислота + метанол =Задание.
- 21. Йорданс Якоб «Пир Клеопатры»
- 22. Карбоновые кислоты: - ДиссоциируютРеагируют с металлами (до
- 23. 1. Изучить параграф 20 стр 191-192 - самостоятельно2.Письменно в тетради:Упражнения 6, 13, 16, 17Домашнее задание
- 24. Молодцы!Мое состояние на уроке
- 25. Спасибо за работу!
Слайд 1Автор-составитель:
Преподаватель ОГАПОУ «СМК»
Бондаренко И.В.
Химические свойства и
применение карбоновых
кислот
«союз
Слайд 2Узнаете, чем органические кислоты похожи на неорганические, и чем они отличаются;
Научитесь
Сегодня вы :
Познакомитесь с химическими свойствами карбоновых кислот;
Слайд 3I. Вариант II. Вариант III. Вариант
с
б 2) d 2) d
а 3) а 3) d
а 4) а, б 4) с
d 5) d 5) б
Ответы
Слайд 8
I. Реакции с разрывом связи О-Н
(кислотные свойства,
II. Реакции с разрывом связи С-О
(замещение группы ОН)
III. Реакции с разрывом связей С-Н (реакции с участием радикала)
Химические свойства
Химические свойства
Слайд 102СН3–СООН + Zn = (СН3СОО)2Zn + H2
Ацетат цинка
Названия солей :
муравьиной –
R–COOH + Me → R–COOMe + H2↑
1.Взаимодействие
с активными металлами
опыт
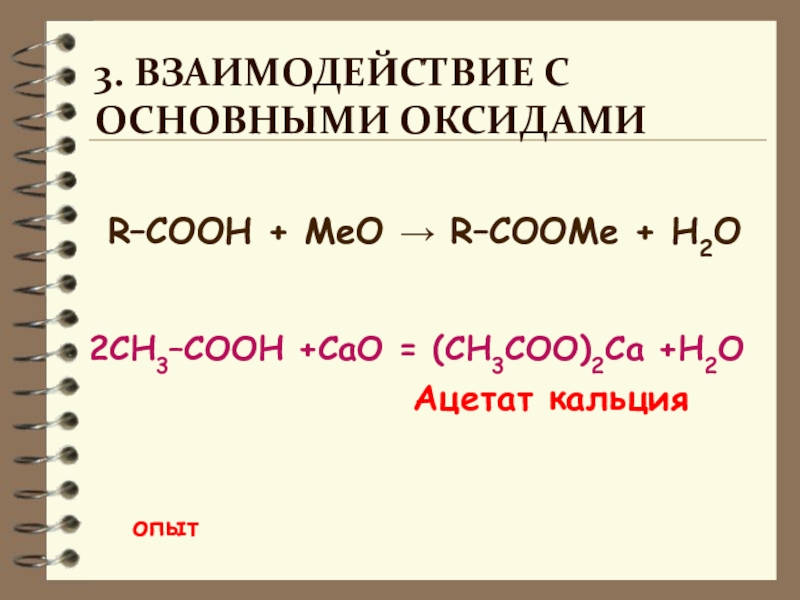
Слайд 11R–COOH + MeО → R–COOMe + H2О
2СН3–СООН +СаО = (СН3СОО)2Са +H2O
3. Взаимодействие с
основными оксидами
опыт
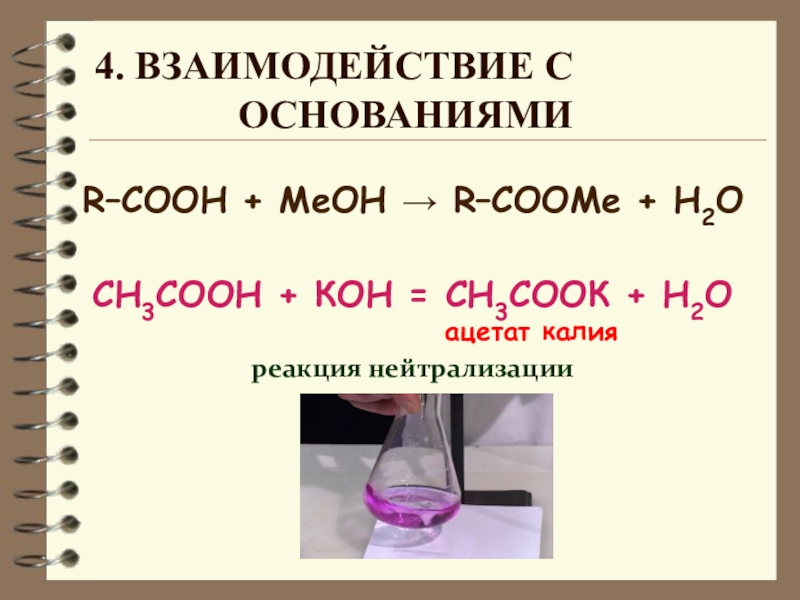
Слайд 12R–COOH + MeОН → R–COOMe + H2О
СН3СООН + КОН = СН3СООК
реакция нейтрализации
4. Взаимодействие с
основаниями
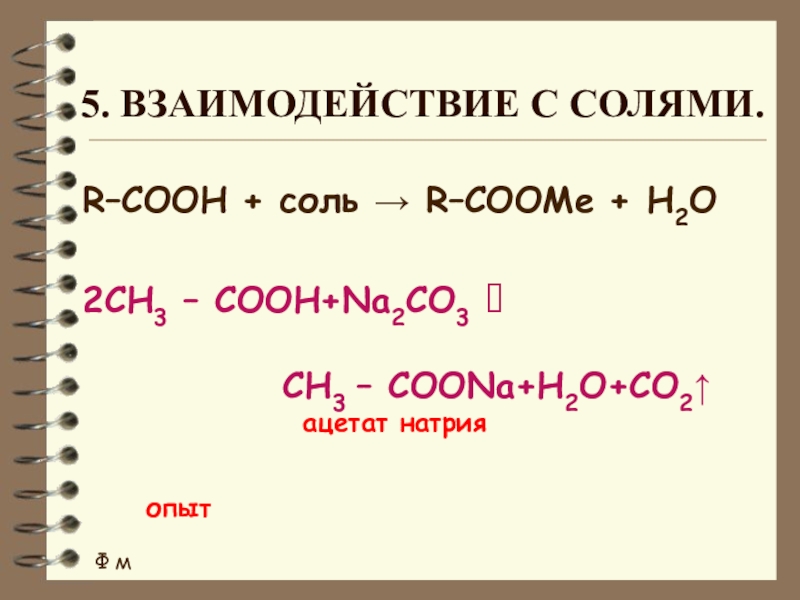
Слайд 135. Взаимодействие с солями.
R–COOH + соль → R–COOMe + H2О
2CH3 –
СH3 – COONa+H2O+CO2
ацетат натрия
опыт
Ф м
Слайд 14II. Реакции с разрывом связи С-О
(замещение группы ОН)
1. Реакция этерификации.
CH3–COOH + HO–C2H5
CH3–COO–C2H5 + H2O
этилацетат,
этиловый эфир уксусной кислоты
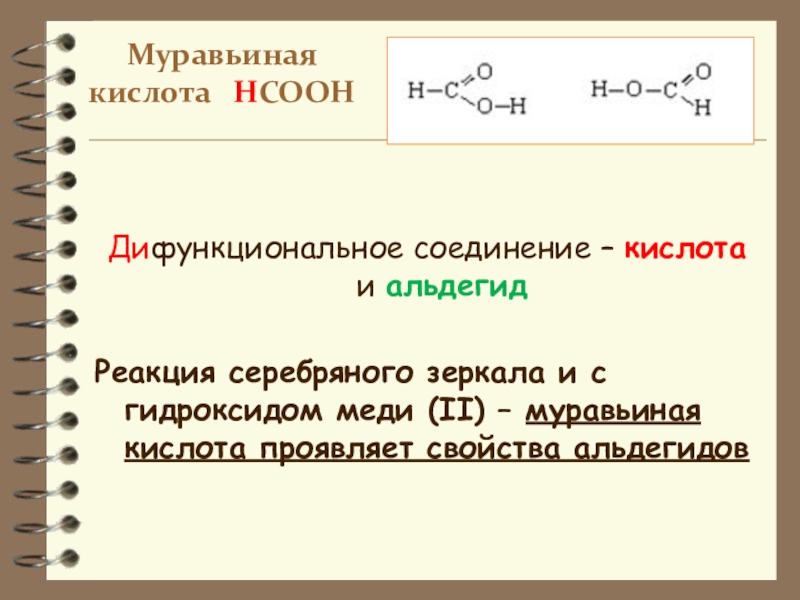
Слайд 18Муравьиная кислота НСООН
Дифункциональное соединение – кислота и альдегид
Реакция серебряного зеркала
Слайд 19Проверь свои знания по карбоновым кислотам
Составьте уравнения химических реакций
Презентация 1
Презентация 2
Выполни
Слайд 201. Уксусная кислота + метанол =
Задание.
Составьте уравнения химических реакции между
2. Муравьиная кислота + гидроксид калия =
3.Пропановая кислота + этанол =
физ
Слайд 21 Йорданс Якоб «Пир Клеопатры» 1653
“Она … опустила
Слайд 22Карбоновые кислоты:
- Диссоциируют
Реагируют с металлами (до водорода)
Реагируют с основными и
Реагируют с основаниями
Реагируют с солями более слабых кислот
Вступают в реакцию этерификации
Галогенирование
Слайд 231. Изучить параграф 20 стр 191-192 - самостоятельно
2.Письменно в тетради:
Упражнения 6,
Домашнее задание