- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по неорганической химии Азот.Аммиак
Содержание
- 1. Презентация по неорганической химии Азот.Аммиак
- 2. Азот был открыт Даниелем Резерфордом в 1772
- 3. В ПСХЭ азот расположен во втором периоде
- 4. . Нахождение в природе В природе азот
- 5. Азот-газ, не имеющий цвета, запаха и вкуса.
- 6. 1)В лаборатории азот можно получить из нитрита
- 7. 1.Как окислитель. При обычной температуре азот
- 8. Важнейшими соединениями азота являются:1)оксид азота(1) N2O2)
- 9. 1)Закись азота(N2O) является обезболивающим средством наркотического типа. 2)Криотерапия жидким азотом(удаление новообразований на коже)Применение
- 10. Биологическая роль азота обусловлена его соединениями. Так
- 11. История открытия:Аммиак был открыт британским химиком Д.
- 12. Молекула аммиака имеет форму пирамиды с атомом
- 13. Небольшие количества аммиака находятся в воздухе в
- 14. 1)NH3 обладает слабыми основными св-миNH3+H2O↔NH4OHNH4OH↔NH4++OH- pH>72)Взаимодействие с
- 15. Физические свойстваАммиак- бесцветный газ с резким удушливым
- 16. 4)Окислительно-восстановительные св-ваN в NH3 в низшей со:-3,
- 17. В медицине р-р аммиака(нашатырный спирт) применяют для
- 18. 1) Взаимодействие солей аммония с щелочьюNH4Cl+KOH=KCl+NH3↑+H2O Наблюдается
Слайд 2Азот был открыт Даниелем Резерфордом в 1772 г. В 1777 г.
История открытия
Слайд 3В ПСХЭ азот расположен во втором периоде V-A группе. На внешнем
Положение в ПСХЭ
Слайд 4.
Нахождение в природе
В природе азот находится в свободном виде
Неорганические соединения азота встречаются в небольших количествах за исключением крупного месторождения натриевой селитры в Чили. Почва содержит незначительные количества азота в виде солей азотной кислоты.
Азот входит в состав органических веществ.
Слайд 5Азот-газ, не имеющий цвета, запаха и вкуса. В 100 мл воды
Физические свойства
Слайд 61)В лаборатории азот можно получить из нитрита аммония термическим разложением NH4NO2
2) В промышленности азот получают при фракционной дистилляции жидкого воздуха или удалением из воздуха кислорода химическим путем, например при реакции С(кокс)+О2=2СО при нагревании. В этих случаях получают азот, содержащий примеси благородных газов(главным образом аргона)
Получение
Слайд 7 1.Как окислитель. При обычной температуре азот соединяется только с литием. 6Li+N2=2Li3N .2.Как
3.При сильных электрических разрядах азот соединяется с кислородом, образуя оксид азота(2) N2+O2=2NO 2NO+O2=2NO2 Азот непосредственно не реагирует с серой, также невозможны реакции со щелочами и водой.
Химические свойства
Слайд 8 Важнейшими соединениями азота являются:
1)оксид азота(1) N2O
2) оксид азота(2) NO
3) оксид
4) оксид азота(4) NO2
5)оксид азота (5)N2O5
6) аммиак NH3
7)азотистая кислота HNO2
8) азотная кислота HNO3
Важнейшие соединения
Слайд 9 1)Закись азота(N2O) является обезболивающим средством наркотического типа.
2)Криотерапия жидким азотом(удаление новообразований
Применение
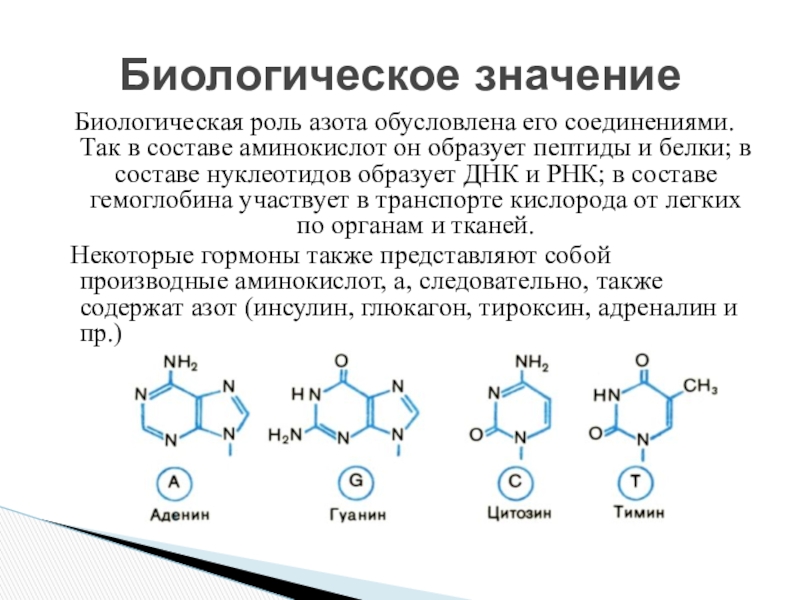
Слайд 10Биологическая роль азота обусловлена его соединениями. Так в составе аминокислот он
Некоторые гормоны также представляют собой производные аминокислот, а, следовательно, также содержат азот (инсулин, глюкагон, тироксин, адреналин и пр.)
Биологическое значение
Слайд 11История открытия:
Аммиак был открыт британским химиком Д. Пристлеем. Именно он назвал
Аммиак
Слайд 12Молекула аммиака имеет форму пирамиды с атомом азота в вершине
Атом азота
У атома азота имеется одна электронная пара, за счет которой может быть образована одна связь по донорно-акцепторному механизму.
Строение аммиака
Слайд 13Небольшие количества аммиака находятся в воздухе в виде углекислой и азотнотнокислой
Основные соединения аммиака:
К основным соединениям аммиака относятся NH4OH-нашатырный спирт и NH4Cl-нашатырь
Нахождение в природе
Слайд 141)NH3 обладает слабыми основными св-ми
NH3+H2O↔NH4OH
NH4OH↔NH4++OH- pH>7
2)Взаимодействие с кислотами
NH3+HCl=NH4Cl
3)Взаимодействует с некоторыми солями,
AgCl +2NH3=(Ag(NH3)2)Cl 4)Окислительно-восстановительные св-ва
N в NH3 в низшей со:-3, поэтому может проявлять только восстановительные св-ва
А)Восстанавливает металлы из их оксидов
Химические свойства
Слайд 15Физические свойства
Аммиак- бесцветный газ с резким удушливым запахом, намного легче воздуха,
Получение:
1)В лабораторных условиях аммиак получают нагревание солей аммония со щелочами
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
2)В промышленности прямое взаимодействие водорода и азота(процесс Габера) N2+3H2=2NH3↑+Q
Слайд 164)Окислительно-восстановительные св-ва
N в NH3 в низшей со:-3, поэтому может проявлять только
А)Восстанавливает металлы из их оксидов
3CuO+2NH3=3Cu+N2+3H2O
Б)Взаимодействует с О2 без катализатора
4NH3+3O2=6H2O+N2
В)При использовании катализатора Pt и при t c O2
4NH3+5O2=4NO+6H2O
Г)Окисление аммиака
8NH3+3Br2=N2+6NH4Br
Слайд 17В медицине р-р аммиака(нашатырный спирт) применяют для возбуждения дыхания и выведения
Биологическое значение: Аммиак является важным источником азота для живых организмов. Является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений.
Применение. Биологическое значение
Слайд 181) Взаимодействие солей аммония с щелочью
NH4Cl+KOH=KCl+NH3↑+H2O
Наблюдается характерный запах аммиака, и
2) С реактивом Несслера
NH4Cl+2K2(HgI4)+4KOH=(OHg2NH2)I+7KI+KCl+H2O
Качественная реакция