- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химий на тему Темір және оның қосылыстары (10 класс)
Содержание
- 1. Презентация по химий на тему Темір және оның қосылыстары (10 класс)
- 2. Темір және оның қосылыстары
- 3. Сабақ мақсаты:Білімділік –темірдің тотығу дәрежесіне байланысты химиялық
- 4. Сабақтың көрнекілігі:Слайдтар,оқулық,металдар коллекциясы,периодтық кесте,реактивтер,тірек- сызба,кеспе қағаздар.Сабақта қолданылатын
- 5. II Үй тапсырмасын сұрау,«Түйсікті ояту»I топ а)Жер
- 6. Мазмұны:Периодтық жүйедегі орны және атом құрылысыТабиғатта таралуыӨнеркәсіпте алынуыФизикалық қасиеттеріХимиялық қасиеттеріТемірдің қосылыстарыҚолданылуы
- 7. Слайд 7
- 8. Темір-VIII Б топ элементі,d-элемент. Темірдің валенттік электрондары
- 9. Слайд 9
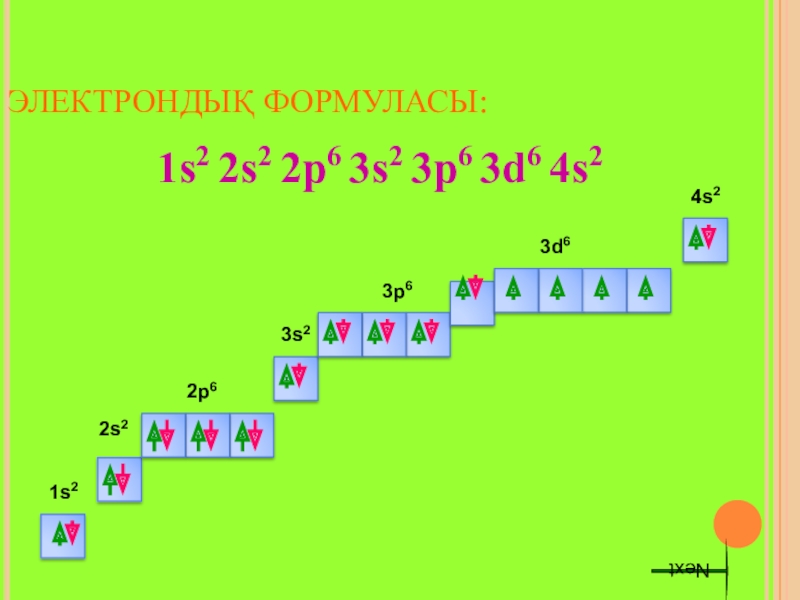
- 10. ЭЛЕКТРОНДЫҚ ФОРМУЛАСЫ:1s2 2s2 2p6 3s2 3p6 3d6 4s21s22s22p63s23p63d64s2Next
- 11. Темір химиялық реакцияларда 2 немесе 3 электрон
- 12. ТАБИҒАТТА ТАРАЛУЫ Темір – табиғатта таралуы бойынша екінші
- 13. Next
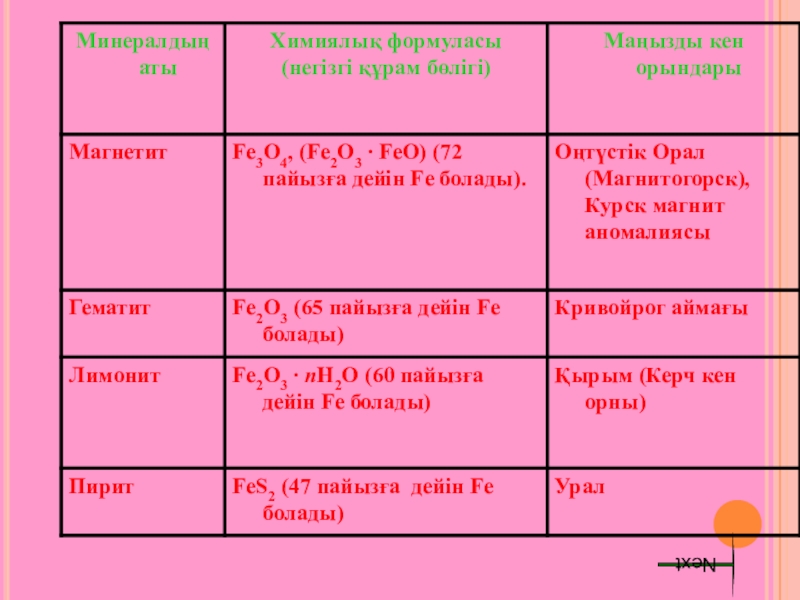
- 14. МИНЕРАЛДАР:Магнетит Гематит Next
- 15. Лимонит Пирит
- 16. Темір тірі организмдерде де болады. Ересек адамның
- 17. Қан азаюының алдыналу үшін картоп, алма,өрік, қара
- 18. Радиация әсерінен гемоглобин синтезделмесе,адам
- 19. ӨНЕРКӘСІПТЕ АЛЫНУЫ:Темірді 3 түрлі әдіспен алуға болады:Пирометаллургиялық
- 20. ФИЗИКАЛЫҚ ҚАСИЕТТЕРІ: Темір – жылтыр, күміс түстес ақ
- 21. Физикалық қасиеттері:
- 22. - Темірдің балқу температурасы- + 1539°С
- 23. ХИМИЯЛЫҚ ҚАСИЕТТЕРІ:I. Жай заттармен әрекеттесуі:Темір оттекте жанғанда
- 24. Ылғалды ауада тат түзеді: 4Fe + 2H2O +
- 25. II. Күрделі заттармен әрекеттесуі:Қатты қыздырылған темір су
- 26. Теміртаудақаласында өндіреді. Балқаш, Қарағанды,Өскемен, Шымкент,Павлодарда түстіметаллургиязауыттары бар.
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. ТЕМІРДІҢ МАҢЫЗДЫ ҚОСЫЛЫСТАРЫ: Темір
- 31. ТЕМІРДІҢ ГИДРОКСИДТЕРІТемірдің ІІ және ІІІ валентті оксидтеріне
- 32. ҚОЛДАНЫЛУЫ:Темір купоросы (FeSO4 ∙ 7H2O) – ағаш
- 33. “OЙ ҚОЗҒАУ” FeO- FeCl2 - Fe(OH)2- FeSO4- BaSO4Fe-Fe(SO4)3- Fe(OH3)- Fe2O3- FeCl3
- 34. “МИҒА ШАБУЫЛ”Есептер шығару
- 35. “КІМ ЖЫЛДАМ”Химиялық тәжірибелер.Берілген реактивтер бойынша мүмкін болатын реакцияларды жүргізіңдер.Fe,HCl,H2SO4,NAOH,FeCl2,CuSO4,HNO3,FeCl3
- 36. “Жүйрік болсаң, шауып көр.”Шығармашылық тапсырма:1. Темір -
- 37. Үйге тапсырма "Темірдің маңызды қосылыстары" "Темір-адам ағзасында"
- 38. Слайд 38
- 39. Назарларыңызға рахмет!
- 40. Ат әбзелдері. Құрамы: темір, күміс және т.б. Ұзындығы 24 см. ХІ ғ-да жасалған. Next
- 41. Ерте кездегі темірден жасалған қайшы. Ұзындығы – 15,5 см. XIV ғасырдың екінші жартысы.Next
- 42. Темірден жасалған бұйымдарNext
- 43. Балта. Ұзындығы – 16 см. ХІ ғасыр.Next
- 44. Темірден жасалған құлып. Ұзындығы – 8,5 см.ХІІ ғасыр.Next
- 45. Темірден жасалған бұйымдарNext
- 46. Темірден жасалған әр түрлі қару-жарақтар.Х – ХІІ ғасырлар.Next
- 47. Темірден жасалған кілттерBack
- 48. Back
- 49. Next
- 50. Next
- 51. Back
- 52. Back
- 53. Back
- 54. Back
- 55. Back
- 56. Қазақстанда темірдің бай қоры бар, ол Торғай
- 57. ТЕМІРДІҢ МАҢЫЗДЫ ҚОСЫЛЫСТАРЫН АНЫҚТАУ:Fe+2 және Fe+3 иондарын
- 58. Темірдің таттануы Темірдің таттануы оттектің
- 59. Темір (ІІІ) оксиді Fe2O3 – амфотерлі оксид,
- 60. 1.Қанға қызыл түс беретін химиялық элемент?
- 61. I- топ:Темір белсенділігі төмен металдарды олардың тұздарынан
Слайд 3
Сабақ мақсаты:
Білімділік –темірдің тотығу дәрежесіне байланысты химиялық қасиеттерін түсіндіру,тотығу дәрежесі +2,
гидроксидтерінің химиялық қасиеттерін қарастыра отырып
толық мәліметтерін беру,пәнге қызығушылығын арттыру,есептер шығару жолдарын үйрету.
Дамытушылық- темір иондарына сапалық реакция жайлы мағлұмат бере отырып ой-өрісін танымдық белсенділігін арттыру,өз бетінше қорытынды жасай білуге дағдыландыру.
Тәрбиелік-оқушылардың ізденімпаздығын іскерлігін қалыптастыру. Жауапкершілікке, уақытты үнемдеуге тәрбиелеу. Химия пәнін ұнатып оқуға баулу.
Слайд 4
Сабақтың көрнекілігі:Слайдтар,оқулық,металдар коллекциясы,периодтық кесте,реактивтер,тірек- сызба,кеспе қағаздар.
Сабақта қолданылатын әдіс-тәсілдер:Сөздік әдісі,түсіндіру,кітаппен жұмыс.
Сабақтың түрі:Аралас
Техникалық құралдар:интерактивті тақта, видео
Пәнаралық байланыс:география,математика, физика, тарих, биология.
I Ұйымдастыру кезеңі:Сәлемдесу,оқушы санын түгендеу,дайындығын ұйымдастыру,топқа бөлу,сабаққа назарын аудару.
Слайд 5
II Үй тапсырмасын сұрау,
«Түйсікті ояту»
I топ а)Жер қыртысында таралу жағынан металдардың
ә)Жемірілуге бейім металл?
II топ Алюминий және алюминий қосылыстары қандай қасиеттер көрсетеді?
Электрөткізгіштігі ең жоғары металл?
III топ Металл оксидтерін алюминиймен тотықсыздандыру?
Темір кені қай жерде орналасқан?
Ivтоп Металдардың жер қойнауында кездесетін қосылыстары қалай аталады ?
Сібір ұстасы сым темір кесегін тапқан.Ол дүние жүзіне әйгілі болып,тұңғыш не деп атаған?
Слайд 6Мазмұны:
Периодтық жүйедегі орны және атом құрылысы
Табиғатта таралуы
Өнеркәсіпте алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Темірдің қосылыстары
Қолданылуы
Слайд 8 Темір-VIII Б топ элементі,d-элемент. Темірдің валенттік электрондары сыртқы s-e және сырттан
Next
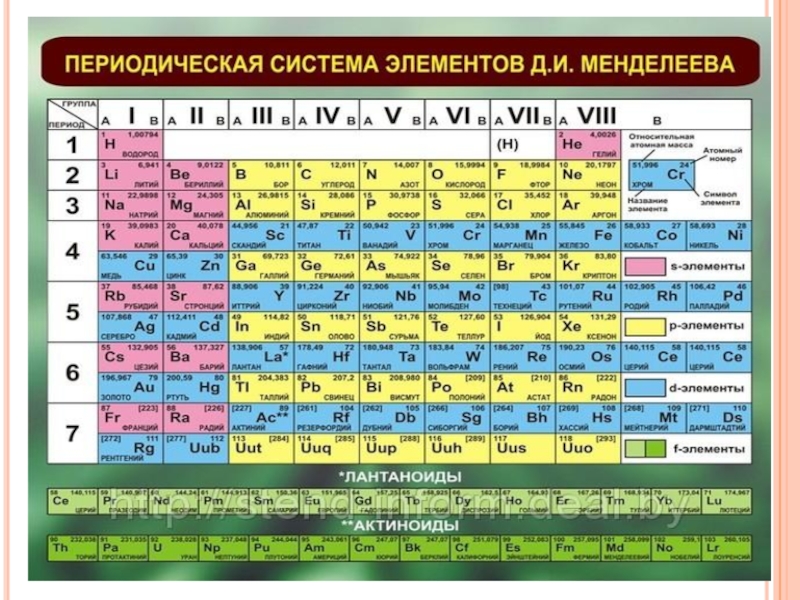
Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы
Слайд 11 Темір химиялық реакцияларда 2 немесе 3 электрон беріп, өзінің тұрақты қосылыстарында
Fe0 – 2e Fe2+
Fe0 – 3e Fe3+
Темірдің тотығу дәрежесі +6 (K2FeO4 – калий ферраты) болатын тұрақтылығы төмен қосылыстары белгілі.
Back
Слайд 12ТАБИҒАТТА ТАРАЛУЫ
Темір – табиғатта таралуы бойынша екінші металл. Оның жер қыртысындағы
Темір минералды сулардың құрамына сульфат (FeSO4) және гидрокарбонат Fe(HCO3)2 түрінде кіреді.
Темір тұздары теңіз суларында бар, мұхит түбінде темірге бай табиғи шөгінділер кездеседі.
Next
Слайд 16 Темір тірі организмдерде де болады. Ересек адамның денесінде 4-5 грамм темір
Байланысқан күйдегі темір көптеген тағамдық өнімдерде: қара нан, картоп, алма, өрік, қарақұмық жармасында кездеседі. Бұл өнімдерді әркім өзінің тамақтану рационына кіргізіп, қан азаюының алдын алуға тиісті.
Слайд 17Қан азаюының алдын
алу үшін картоп, алма,
өрік, қара бидай
нанының және тәтті
көкөністердің маңызы
өте
кездесетін байланысқан
күйіндегі темір қанның
қызыл түсін сақтап,
гемоглобиннің
төмендеуіне жол бермейді.
.
Слайд 18 Радиация әсерінен гемоглобин
синтезделмесе,адам ақ қан ауруына
шалдығады.Медицинада
дәрілік препараттары,изотоптары
52 Fe, 55Fe, 59Fe зерттеу кезінде
индикатор ретінде қан ауруын
анықтауға қолданылады.
Темірдің медицинамен байланысы
Слайд 19ӨНЕРКӘСІПТЕ АЛЫНУЫ:
Темірді 3 түрлі әдіспен алуға болады:
Пирометаллургиялық әдіспен:
оксидінен тотықсыздандыру арқылы:
Fe2O3 +
соның ішінде алюминтермиялық әдіспен:
Fe2O3 + 2Al = Al2O3 + 2Fe
және көміртек (ІІ) оксидімен тотықсыздан-дыру арқылы:
Fe3O4 + 4CO = 3Fe + 4CO2
Back
Слайд 20ФИЗИКАЛЫҚ ҚАСИЕТТЕРІ:
Темір – жылтыр, күміс түстес ақ металл, оның тығыздығы –
Back
Слайд 23ХИМИЯЛЫҚ ҚАСИЕТТЕРІ:
I. Жай заттармен әрекеттесуі:
Темір оттекте жанғанда екі тотығу дәрежесін де
3Fe + 2O2 = Fe3O4
Next
Слайд 24Ылғалды ауада тат түзеді:
4Fe + 2H2O + 3O2 = 4Fe(OH) 2
Белсенді
2Fe + 3Cl2 = 2Fe3+ Cl3-
Fe + S = FeS
4Fe + 3C = Fe4C3
Слайд 25II. Күрделі заттармен әрекеттесуі:
Қатты қыздырылған темір су буымен әрекеттеседі:
Fe + H2O
Концентрлі азот және күкірт қышқылдарында темір енжарланады, өйткені ерімейтін қосылыстардың қорғағыш қабатшасымен қапталады.
Сұйылтылған азот және күкірт қышқылдарымен әрекеттесіп, темір тотықсызданады:
Fe + 4HNO3(сұйық) = Fe(NO3)3 + NO + 2H2O
Fe + H2SO4(сұйық) = FeSO4 + H2
Темір белсенділігі төмен металдарды олардың тұздарынан тотықсыздандырып, ығыстырып шығарады:
Fe + CuCl2 = FeCl2 + Cu
Слайд 26Теміртауда
қаласында
өндіреді. Балқаш,
Қарағанды,
Өскемен, Шымкент,
Павлодарда түсті
металлургия
зауыттары бар.
Слайд 30
ТЕМІРДІҢ МАҢЫЗДЫ ҚОСЫЛЫСТАРЫ:
Темір (ІІ) оксиді немесе (FeO) – негіздік
Fe2O3 + CO 2FeO + CO2
Қышқылдармен және қышқылдық оксидтермен әрекеттесіп тұз түзеді:
FeO + 2HCl = FeCl2 + H2O
FeO + CO2 = FeCO3
Next
Слайд 31ТЕМІРДІҢ ГИДРОКСИДТЕРІ
Темірдің ІІ және ІІІ валентті оксидтеріне екі түрлі гидроксидтері сәйкес
Fe (II) гидроксиді – ақ түсті, ал Fe (III) гидроксиді – қызыл-қоңыр түсті. Олар суда ерімейтін заттар.
І. Алынуы. FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl
FeCl3 + 2NaOH = Fe(OH)3 + 3NaCl
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Слайд 32ҚОЛДАНЫЛУЫ:
Темір купоросы (FeSO4 ∙ 7H2O) – ағаш сүрлеуде;
Fe3C – цементит шойында
(NH4)2SO4 ∙ FeSO4 ∙ 6H2O – Мор тұзы, тотықсыздандырғыш ретінде пайдаланылады.
Fe(NH4)2 ∙ (SO4)2 ∙ 12H2O – темір-аммонийлі ашудас, тері илеуде қолданылады.
Fe2O3 – темір сүрегі (бояу) шатырларды бояуда, болат пен шыны беттерін тегістеуде, термиялық пісіруде қолданылады.
Слайд 34“МИҒА ШАБУЫЛ”
Есептер шығару
Слайд 35“КІМ ЖЫЛДАМ”
Химиялық тәжірибелер.
Берілген реактивтер бойынша мүмкін болатын реакцияларды жүргізіңдер.
Fe,HCl,H2SO4,NAOH,FeCl2,CuSO4,HNO3,FeCl3
Слайд 36“Жүйрік болсаң, шауып көр.”
Шығармашылық тапсырма:
1. Темір - аспан тасы.
2. Темір -
3. Темір - тіршілік көзі
4. Темір – өмірдегі маңызды элемент.
Слайд 37Үйге тапсырма
"Темірдің маңызды қосылыстары" "Темір-адам ағзасында" "Темір табиғатта" "Темір ежелгі
Слайд 38 Рефлексия
Бүгінгі
Жеңіл Орташа Қиын
Берілген материалдарды қалай меңгердің?
Толық меңгердім;
Аздап меңгердім;
Мүлдем меңгерген жоқпын.
Слайд 56 Қазақстанда темірдің бай қоры бар, ол Торғай темір кенді бассейнінде және
Темір сульфат және гидрокарбонат түрінде минералды сулардың құрамына кіреді. Темір тұздары теңіз суларында да бар, сол сияқты мұхиттардың түбінде де темірге әжептәуір бай табиғи шөгінділер кездеседі.
Слайд 57ТЕМІРДІҢ МАҢЫЗДЫ ҚОСЫЛЫСТАРЫН АНЫҚТАУ:
Fe+2 және Fe+3 иондарын сары және қызыл қан
3FeCl2 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 6KCl
турунбуль көгі
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl
берлин көгі
Слайд 58Темірдің таттануы
Темірдің таттануы оттектің әсерінен болады.
2Fe0 + 2H2O
Тотықсыздандырғыш 2Fe0 -2e- 4 2
Тотықтырғыш 2O0 +4e- 2 1
Оттек молекуласы темірді алдымен Fe+2, содан кейін Fe+3 катионына айналдырады:
4Fe(OH)2 + 2H2O + O2o → 4Fe(OH)3
Тотықсыздандырғыш Fe+2 -e– → Fe+3 1 4
Тотықтырғыш O20 +4e- → 2O-2 4 1
Слайд 59Темір (ІІІ) оксиді Fe2O3 – амфотерлі оксид, бірақ негіздік қасиеті басымдау,
І. Алынуы: 1) 2Fe(OH)3 = Fe2O3 + 3H2O
2) 3Fe + 2O2 = Fe3O4
3) 3Fe + 4HOH = Fe3O4 + 4H2
ІІ. Химиялық қасиеттері:
қышқылмен Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
қышқылдық оксидпен Fe2O3 + 3SO3 = Fe2(SO4)3
негізбен Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Next
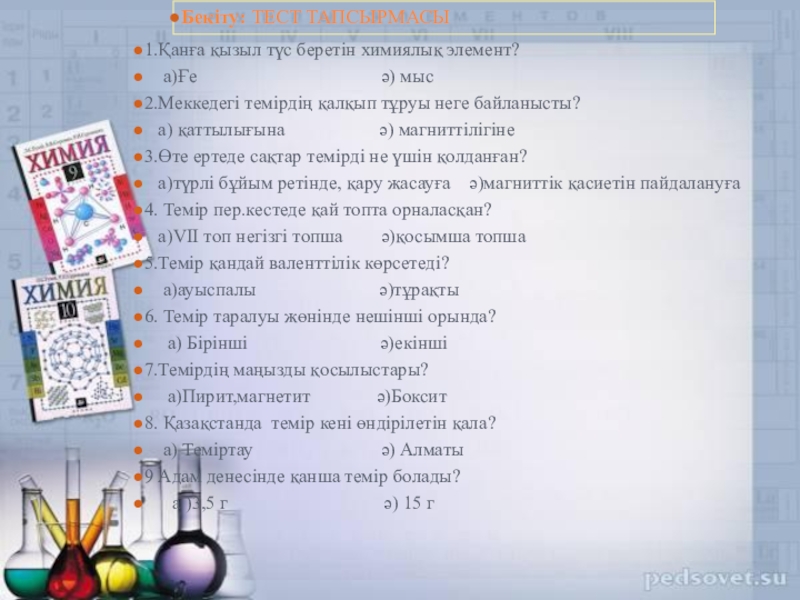
Слайд 601.Қанға қызыл түс беретін химиялық элемент?
а)Ғе
2.Меккедегі темірдің қалқып тұруы неге байланысты?
а) қаттылығына ә) магниттілігіне
3.Өте ертеде сақтар темірді не үшін қолданған?
а)түрлі бұйым ретінде, қару жасауға ә)магниттік қасиетін пайдалануға
4. Темір пер.кестеде қай топта орналасқан?
а)VІІ топ негізгі топша ә)қосымша топша
5.Темір қандай валенттілік көрсетеді?
а)ауыспалы ә)тұрақты
6. Темір таралуы жөнінде нешінші орында?
а) Бірінші ә)екінші
7.Темірдің маңызды қосылыстары?
а)Пирит,магнетит ә)Боксит
8. Қазақстанда темір кені өндірілетін қала?
а) Теміртау ә) Алматы
9 Адам денесінде қанша темір болады?
а )3,5 г ә) 15 г
Бекіту: ТЕСТ ТАПСЫРМАСЫ
Слайд 61I- топ:Темір белсенділігі төмен металдарды олардың тұздарынан тотықсыздандырып,ығыстырып шығарады:
Fe+CuSO4=FeSO4+Cu
III- топ:Темірдің суда
Fe+CL2+2NaOH=Fe(OH)2↓ +2NaCL
V- топ:темірдің қышқылмен әрекеттесуін қарастырайық .Нәтижесінде сутек газы бөлінеді.
2Fe+3H2SO4=Fe2(SO4)3+3H2↓





















































![Презентация по химий на тему Темір және оның қосылыстары (10 класс) ТЕМІРДІҢ МАҢЫЗДЫ ҚОСЫЛЫСТАРЫН АНЫҚТАУ:Fe+2 және Fe+3 иондарын сары және қызыл қан ТЕМІРДІҢ МАҢЫЗДЫ ҚОСЫЛЫСТАРЫН АНЫҚТАУ:Fe+2 және Fe+3 иондарын сары және қызыл қан тұздарының көмегімен анықтайды.3FeCl2 + 2K3[Fe(CN)6] =](/img/thumbs/680f668b7e2e6921744619d5ad54f84a-800x.jpg)