«Заречненская школа
с крымскотатарским языком обучения»
Мемедиминова А. К.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии:Вода, физические и химические свойства. Способы ее получения
Содержание
- 1. Презентация по химии:Вода, физические и химические свойства. Способы ее получения
- 2. Вода – вещество привычное и необычное.Известный советский
- 3. "Вода! У тебя нет ни вкуса, ни
- 4. Почти 70% поверхности нашей планеты занято океанами
- 5. Состав молекулы водыСостав молекулы воды вам хорошо
- 6. Физические свойства водыЧистая вода - бесцветная жидкость, без вкуса
- 7. Химические свойства водыПри изучении способов получения водорода
- 8. Опыт 1. В фарфоровую чашку помещают
- 9. Опыт 2. Наливают в химический стакан немного
- 10. Примеры важнейших химических реакций с водой1. Вода реагирует с
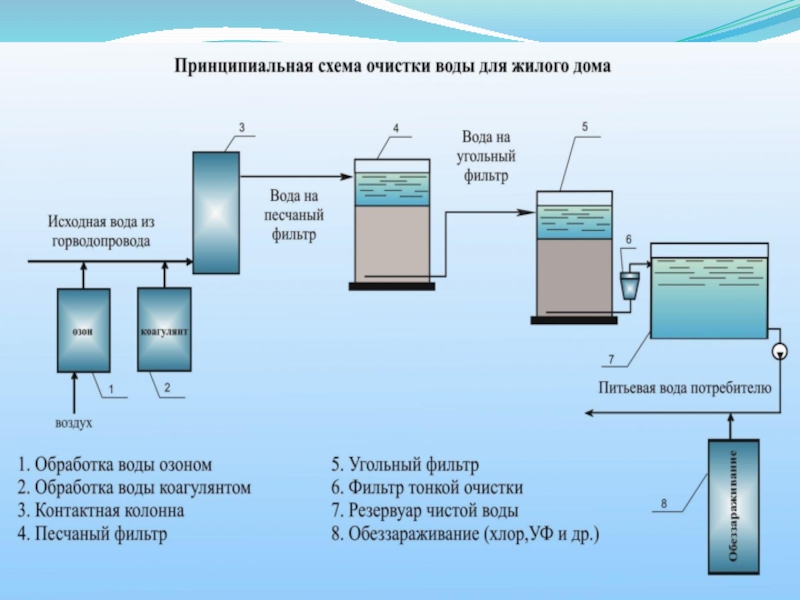
- 11. Способы очистки водыФизические;Химические;Физико-химические;Биологические.
- 12. К основным физическим методам очистки воды относят: процеживание;отстаивание;фильтрование (в том числе центробежное);ультрафиолетовая обработка.
- 13. Химические способы (методы) очистки воды нейтрализация;окисление;восстановление.
- 14. Физико-химические способы очистки воды флотация;сорбция;экстракция;ионообмен;электродиализ;обратный осмос;термические методы.
- 15. Биологические способы(методы) очистки воды биологические пруды;поля фильтрации;биофильтры;аэротенки (окситенки);метантенки.
- 16. Слайд 16
- 17. Вода — добрый друг и помощник человека!!!
Вода – вещество привычное и необычное.Известный советский ученый академик И.В.Петрянов свою научно – популярную книгу о воде назвал “Самое необыкновенное вещество в мире”. А доктор биологических наук Б.Ф.Сергеев начал свою книгу “Занимательная физиология” с главы о
Слайд 1Вода. Физические и химические свойства воды. Способы ее очистки.
Подготовила:
учитель химии МОУ
Слайд 2Вода – вещество привычное и необычное.
Известный советский ученый академик И.В.Петрянов свою
научно – популярную книгу о воде назвал
“Самое необыкновенное вещество в мире”.
А доктор биологических наук Б.Ф.Сергеев начал свою книгу “Занимательная физиология” с главы о воде – “Вещество, которое создало нашу планету”.
“Самое необыкновенное вещество в мире”.
А доктор биологических наук Б.Ф.Сергеев начал свою книгу “Занимательная физиология” с главы о воде – “Вещество, которое создало нашу планету”.
Слайд 3"Вода! У тебя нет ни вкуса, ни запаха, тебя невозможно описать,
тобой наслаждаться, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни: ты - сама жизнь. Ты наполняешь нас радостью, которую не объяснить нашими чувствами... Ты самое большое богатство на свете..."
Антуан де Сент Экзюпери.
Антуан де Сент Экзюпери.
Слайд 4Почти 70% поверхности нашей планеты занято океанами и морями. Твёрдой водой
– снегом и льдом – покрыто 20% суши.
Почти 75% пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 25% - в водоносных слоях под землёй, а в руслах всех рек содержатся одновременно всего лишь 0,006% пресных вод.
Это единственное вещество, которое встречается в трех агрегатных состояниях:
твердом, жидком и газообразном.
Почти 75% пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 25% - в водоносных слоях под землёй, а в руслах всех рек содержатся одновременно всего лишь 0,006% пресных вод.
Это единственное вещество, которое встречается в трех агрегатных состояниях:
твердом, жидком и газообразном.
Слайд 5Состав молекулы воды
Состав молекулы воды вам хорошо знаком: на два атома
водорода в молекуле воды приходится один атом кислорода, ее химическая формула – Н2О. Такой состав был установлен еще А.Л. Лавуазье и подтверждается результатами эксперимента по разложению воды, когда на 1 объем выделяющегося кислорода приходится два объема выделяющегося водорода.
Слайд 6Физические свойства воды
Чистая вода - бесцветная жидкость, без вкуса и запаха, кипит при
100oC (при давлении 101,3 кПа), замерзает при 0oC, ее максимальная плотность (при 4oC) равна 1г/см3.Лед имеет меньшую плотность плотность, чем жидкая вода , и всплывает на ее поверхность, что очень важно для обитателей водоемов зимой.
Вода обладает исключительно большой теплоемкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому водные бассейны регулируют температуру на нашей планете.
Вода обладает исключительно большой теплоемкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому водные бассейны регулируют температуру на нашей планете.
Слайд 7Химические свойства воды
При изучении способов получения водорода вы ознакомились с некоторыми
свойствами воды. Вода вступает в реакции замещения с активными металлами.
Под действием постоянного электрического тока или высокой температуры (2000С) вода разлагается на водород и кислород
Вода вступает в реакции соединения со многими сложными веществами, например с оксидами. В этом можно убедится, проделав следующие опыты.
Вода вступает в реакции соединения со многими сложными веществами, например с оксидами. В этом можно убедится, проделав следующие опыты.
Слайд 8Опыт 1. В фарфоровую чашку помещают
немного свежепрокаленного оксида кальция CaO (жженая известь) и обливают его водой. В результате образуется рыхлый порошок, при растворении которого в воде получается мыльный на ощупь раствор.
CaO + H2O=Ca(OH)2
CaO + H2O=Ca(OH)2
Слайд 9Опыт 2. Наливают в химический стакан немного воды, добавляют несколько капель
раствора фиолетового лакмуса и сжигают над водой в металлической ложечке красный фосфор. Образовавшийся в воде белого дыма оксид фосфора (V) P2O5 постепенно растворяется в воде и реагирует с ней. Это подтверждает изменение фиолетовой окраски лакмуса на красную. В данном случае образуется метафосфорная кислота:
P2O5+H2O=2HPO3
При повышенной температуре (кипячении) образуется ортофосфорная кислота:
P2O5+3H2O=2H3PO4
P2O5+H2O=2HPO3
При повышенной температуре (кипячении) образуется ортофосфорная кислота:
P2O5+3H2O=2H3PO4
Слайд 10Примеры важнейших химических реакций с водой
1. Вода реагирует с активными металлами. Образуются растворимые
гидроксиды (щелочи) и водород: 2Li+HOH=2LiOH+H2
2. Вода реагирует с менее активными металлами при нагревании. Продукты реакции - оксиды металлов и водород:
Zn + H2O=ZnO + H2 3Fe + 4H2O=FeO+Fe2O3 или Fe3O4+4H2
3. Вода реагирует с некоторыми неметаллами (продукты реакции разнообразны): C + H2O=CO + H2
4. Вода реагирует с оксидами активных металлов, при этом получаются растворимые гидроксиды (щелочи): Li2O+H2O=2LiOH
5. Вода реагирует почти со всеми оксидами неметаллов с образованием кислот: SO3 +H2O=H2SO4
Под действием постоянного электрического тока или при высокой температуре вода разлагается: 2H2O=2H2+O2
2. Вода реагирует с менее активными металлами при нагревании. Продукты реакции - оксиды металлов и водород:
Zn + H2O=ZnO + H2 3Fe + 4H2O=FeO+Fe2O3 или Fe3O4+4H2
3. Вода реагирует с некоторыми неметаллами (продукты реакции разнообразны): C + H2O=CO + H2
4. Вода реагирует с оксидами активных металлов, при этом получаются растворимые гидроксиды (щелочи): Li2O+H2O=2LiOH
5. Вода реагирует почти со всеми оксидами неметаллов с образованием кислот: SO3 +H2O=H2SO4
Под действием постоянного электрического тока или при высокой температуре вода разлагается: 2H2O=2H2+O2
Слайд 12К основным физическим методам очистки воды относят:
процеживание;
отстаивание;
фильтрование (в том числе центробежное);
ультрафиолетовая
обработка.