- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химиии на тему Алюминий и его соединения (9 класс)
Содержание
- 1. Презентация по химиии на тему Алюминий и его соединения (9 класс)
- 2. Алюминий – самый распространенный в природе металл.
- 3. Важнейшим на сегодня минералом алюминия является бокситОсновной
- 4. AL2O3КорундсапфиррубинБокситГлинозём
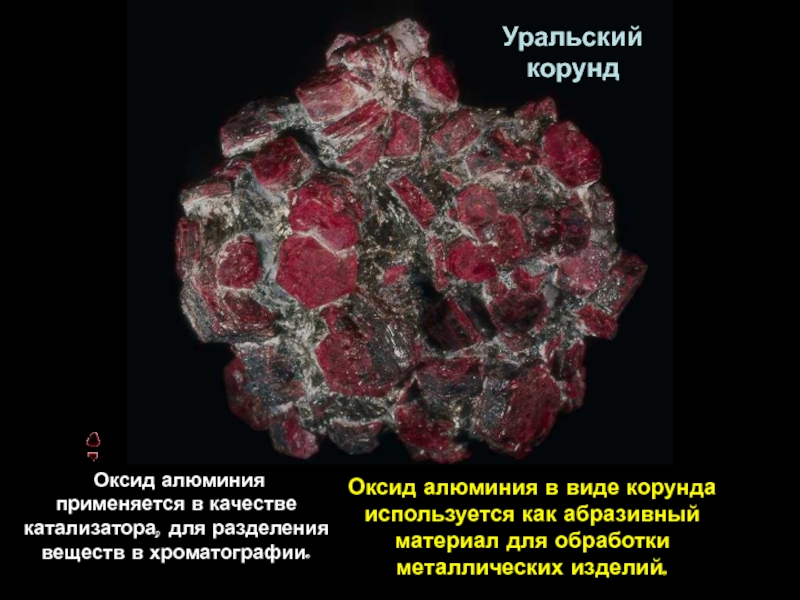
- 5. Уральский корундОксид алюминия в виде корунда
- 6. Применение сапфировзнаменитые сапфиры английской королевской семьи
- 7. Применение рубинов
- 8. Рубины и сапфиры в наше время
- 9. Алюминий входит в состав глин, полевых шпатов,
- 10. Алюминий ( лат. Aluminium название образовано
- 11. Составьте схему строения атома алюминия.Определите какая
- 12. Алюминий – серебристый металл,
- 13. Слайд 13
- 14. Будучи студентом Оберлинского колледжа, он
- 15. Поль Эру (1863-1914) –французский инженер - химикВ
- 16. химические свойства : I. Реакции с простыми веществами:
- 17. Слайд 17
- 18. б) с серой, образуя сульфид алюминия: Al
- 19. 1. с водой (после удаления защитной оксидной
- 20. III. Соединения алюминия Соединения алюминияОксид алюминия (AL2O3)Гидроксид алюминияAL(OH)3
- 21. Химические свойства оксида алюминияАмфотерный оксидРеагирует с кислотамиРеагирует с щелочамиAL2O3 + 6HCL=2ALCL3 + 3H2OAL2O3+ 2NaOH +3H2O=2Na[AL(OH)4]
- 22. Гидроксид алюминия AL(OH)3
- 23. Реагирует с кислотамиРеагирует с щелочамиAL(OH)3 + 3HCL
- 24. Закончите уравнения реакций и запишите
- 25. Соединения алюминия Задание: прочтите на стр. 71-74 и заполните таблицу
- 26. Применение алюминия и его соединений
- 27. Вставьте пропущенные слова в текст:Проверьте себя:Алюминий –
- 28. Какие из соединений вступят в реакцию с алюминием:Cl2K2OCuSO4H2OSBaSO4HCLCrFe2O3
- 29. Домашнее задание: § 13; записи в тетради, на стр.75, упр.6.
Слайд 3Важнейшим на сегодня минералом алюминия является боксит
Основной химический компонент боксита -
(28 - 80%).
Нахождение в природе
Слайд 5
Уральский
корунд
Оксид алюминия в виде корунда используется как абразивный
Оксид алюминия применяется в качестве катализатора, для разделения веществ в хроматографии.
Слайд 8 Рубины и сапфиры в наше время получают искусственным путем в
Оксид алюминия в виде рубина широко используется в лазерной технике.
Слайд 9Алюминий входит в состав глин, полевых шпатов, слюд. Важнейший минерал алюминия
боксит
нефелин
?
Слайд 10 Алюминий ( лат. Aluminium
название образовано от лат. «Aluminis» –
I. Положение алюминия в ПСХЭ Д.И.Менделеева.
Слайд 11 Составьте схему строения атома алюминия.
Определите какая степень окисления характерна для
Какие свойства проявляет алюминий в реакциях?
Слайд 12 Алюминий – серебристый металл,
II. Алюминий – простое вещество.
Физические свойства.
Слайд 14
Будучи студентом Оберлинского колледжа,
он узнал, что можно
в промышленных масштабах.
Как одержимый, Чарльз проводил эксперименты
по выработке алюминия путем электролиза криолитно-глиноземного расплава.
23 февраля 1886 года спустя год после окончания колледжа Чарльз получил с помощью электролиза первый алюминий.
Холл Чарльз
(1863 – 1914) американский инженер-химик
Слайд 15Поль Эру (1863-1914) –
французский
инженер - химик
В 1889 году открыл алюминиевый
Слайд 18б) с серой, образуя сульфид алюминия:
Al + S = ….
в)
Al + N2 = …
г) с углеродом, образуя карбид алюминия:
Al + С = ….
д) с хлором, образуя хлорид алюминия:
Al + Cl2 = …..
а) с кислородом, образуя оксид алюминия:
Al + O2 = …..
I. Реакции с простыми веществами:
Слайд 191. с водой (после удаления защитной оксидной пленки)
Al + H2O = …..
2. с растворами щелочей (с образов. алюминатов)
Al + NaOH + H2O =……
3. c соляной и разбавленной серной кислотами:
Al + HCl = ……
Al + H2SO4 (разб) = ……..
4. с оксидами менее активных металлов (алюминотермия)
Al + Fe3O4 =…….
II. Реакции со сложными веществами:
Слайд 21Химические свойства оксида алюминия
Амфотерный оксид
Реагирует с кислотами
Реагирует с щелочами
AL2O3 + 6HCL=2ALCL3
AL2O3+ 2NaOH +3H2O=2Na[AL(OH)4]
Слайд 23
Реагирует с кислотами
Реагирует с щелочами
AL(OH)3 + 3HCL = ALCL3+ 3H2O
AL(OH)3 +
Амфотерный
Химические свойства
гидроксида алюминия
Слайд 24 Закончите уравнения реакций и запишите их в ионном виде:
AL2O3+
Al2O3 + HCl = …..
Al(OH)3 + HCl = …..
Al(OH)3 + NaOH = Na[AL(OH)4]
Слайд 27Вставьте пропущенные слова в текст:
Проверьте себя:
Алюминий – это металл, у которого
В природе он встречается в виде .
+3
оксида алюминия
Алюминий может вступать в реакцию с , образуя гидроксид алюминия, который обладает
.
водой
амфотерностью
Алюминий вступает в реакцию для восстановления менее активных металлов из их оксидов.
алюминотермии



















![Презентация по химиии на тему Алюминий и его соединения (9 класс) Химические свойства оксида алюминияАмфотерный оксидРеагирует с кислотамиРеагирует с щелочамиAL2O3 + 6HCL=2ALCL3 + 3H2OAL2O3+ 2NaOH +3H2O=2Na[AL(OH)4] Химические свойства оксида алюминияАмфотерный оксидРеагирует с кислотамиРеагирует с щелочамиAL2O3 + 6HCL=2ALCL3 + 3H2OAL2O3+ 2NaOH +3H2O=2Na[AL(OH)4]](/img/thumbs/16def77f09b498ec8685b5d121f9a1d6-800x.jpg)

![Презентация по химиии на тему Алюминий и его соединения (9 класс) Реагирует с кислотамиРеагирует с щелочамиAL(OH)3 + 3HCL = ALCL3+ 3H2OAL(OH)3 + Реагирует с кислотамиРеагирует с щелочамиAL(OH)3 + 3HCL = ALCL3+ 3H2OAL(OH)3 + NaOH = Nа[AL(OH)4 ]АмфотерныйХимические свойства гидроксида](/img/thumbs/c63b3c911dac4904a57d72848c6261f1-800x.jpg)
![Презентация по химиии на тему Алюминий и его соединения (9 класс) Закончите уравнения реакций и запишите их в ионном виде:AL2O3+ NaOH Закончите уравнения реакций и запишите их в ионном виде:AL2O3+ NaOH + H2O = Na[AL(OH)4]Al2O3 +](/img/thumbs/d2a8a34387d31538bbef8bb93be2c714-800x.jpg)










