- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Золото
Содержание
- 1. Презентация по химии Золото
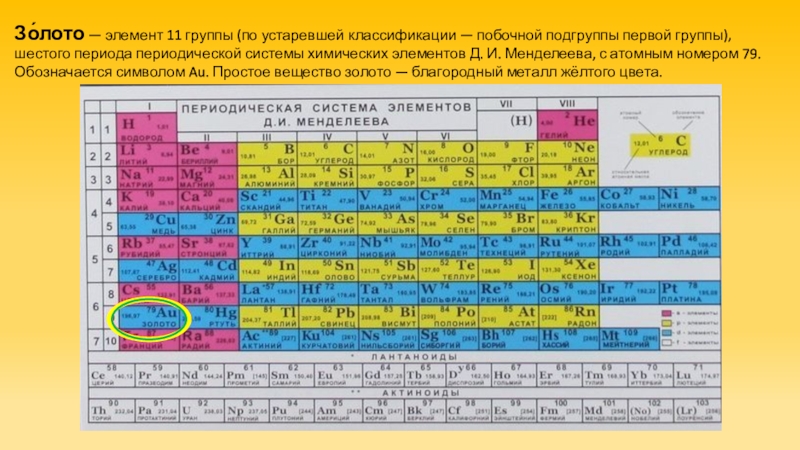
- 2. Зо́лото — элемент 11 группы (по устаревшей
- 3. Чистое золото — мягкий металл жёлтого цвета.
- 4. Химические свойстваЗолото — один из самых инертных
- 5. Степень окисления +2 для золота нехарактерна, в
- 6. Физиологическое воздействиеНекоторые соединения золота токсичны, накапливаются в
- 7. ДобычаЛюди добывают золото с незапамятных времён. С
- 8. В России до елизаветинских времён золото не
- 9. ПолучениеДля получения золота используются его основные физические
- 10. ПрименениеИмеющееся в настоящее время в мире золото
- 11. В ювелирных изделияхТрадиционным и самым крупным потребителем
- 12. Запасы В РоссииПредполагаемые золотые резервы стран мира
- 13. Спасибо за внимание
Слайд 2Зо́лото — элемент 11 группы (по устаревшей классификации — побочной подгруппы
Слайд 3Чистое золото — мягкий металл жёлтого цвета. Красноватый оттенок некоторым изделиям
Золото — очень тяжёлый металл. Среди металлов по плотности занимает седьмое место после осмия, иридия, платины, рения, нептуния и плутония. Сопоставимую с золотом плотность имеет вольфрам (19,25). Высокая плотность золота облегчает его добычу, отчего даже простые технологические процессы — например, промывка на шлюзах, — могут обеспечить высокую степень извлечения золота из промываемой породы.
Золото — очень мягкий металл (сравнима с твёрдостью ногтя).
Золото также высокопластично: оно может быть проковано в листки толщиной до ~0,1 мкм (100 нм) (сусальное золото); при такой толщине золото полупрозрачно и в отражённом свете имеет жёлтый цвет, в проходящем — окрашено в дополнительный к жёлтому синевато-зеленоватый. Золото может быть вытянуто в проволоку с линейной плотностью до 2 мг/м.
Температура плавления золота 1064,18 °C, кипит при 2856 °C. Плотность жидкого золота меньше, чем твёрдого, и составляет 17 г/см3 при температуре плавления. Жидкое золото довольно летучее, оно активно испаряется задолго до температуры кипения.
Слайд 4Химические свойства
Золото — один из самых инертных металлов, стоящее в ряду
Наиболее устойчивая степень окисления золота в соединениях +3. Относительно устойчивы также соединения со степенью окисления +1. Долгое время считалось, что +3 — высшая из возможных степеней окисления золота, однако, используя дифторид криптона(KrF2), удалось получить соединения Au+5 (фторид AuF5). Соединения золота(V) стабильны лишь со фтором и являются сильнейшими окислителями.
Слайд 5Степень окисления +2 для золота нехарактерна, в веществах, в которых она
Существуют соединения золота со степенью окисления −1, называемые ауридами. Например, CsAu (аурид цезия), Na3Au (аурид натрия).
Из чистых кислот золото растворяется только в концентрированной селеновой кислоте при 200 °C
Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты
Слайд 6Физиологическое воздействие
Некоторые соединения золота токсичны, накапливаются в почках, печени, селезёнке и
Геохимия
Содержание золота в земной коре очень низкое — 4,3·10-10 % по массе, но месторождения и участки, резко обогащённые металлом, весьма многочисленны. Золото содержится и в воде. Один литр и морской, и речной воды содержит менее 5·10−9 граммов Au, что примерно соответствует 5 килограммам золота в 1 кубическом километре воды.
золото является очень устойчивым элементом и легко накапливается в россыпях. Однако золото, входящее в состав сульфидов, при окислении последних приобретает способность мигрировать в зоне окисления. В результате золото иногда накапливается в зоне вторичного сульфидного обогащения, но максимальные его концентрации связаны с накоплением в зоне окисления. Миграция золота в зоне окисления сульфидных месторождений происходит в виде бромистого и йодистого соединений в ионной форме.
Слайд 7Добыча
Люди добывают золото с незапамятных времён. С золотом человечество столкнулось уже
По предположению археологов, начало системной добычи было положено на Ближнем Востоке, откуда золотые украшения поставлялись, в частности, в Египет. Именно в Египте в гробнице королевы Зер и одной из королев Пу-аби Ур в Шумерской цивилизации были найдены первые золотые украшения, датируемые III тыс. до н. э.
Слайд 8В России до елизаветинских времён золото не добывалось. Оно ввозилось из-за
За всю историю человечеством добыто около 161 тысячи тонн золота, рыночная стоимость которого 8-9 триллионов долларов
Слайд 9Получение
Для получения золота используются его основные физические и химические свойства: присутствие
В 1947 году американские физики Ингрем, Гесс и Гайдн проводили эксперимент по измерению эффективного сечения поглощения нейтронов ядрами ртути. Таким образом, была осуществлена многовековая мечта алхимиков — трансмутация ртути в золото. Однако экономического значения такое производство золота не имеет, так как обходится во много раз дороже добычи золота из самых бедных руд.
Золотой самородок
Слайд 10Применение
Имеющееся в настоящее время в мире золото распределено так: около 10
Как объект инвестирования
Золото издавна использовалось многими народами в качестве денег. Золотые монеты — наиболее хорошо сохраняющийся памятник старины. Однако как монопольный денежный товар золотые монеты утвердились только к XIX веку. Вплоть до Первой мировой войны все мировые валюты были основаны на золотом стандарте (период 1870—1914 называют «золотым веком»). Бумажные купюры в это время выполняли функцию удостоверений о наличии золота. Они свободно обменивались на золото.
В промышленности
По своей химической стойкости и механической прочности золото уступает большинству платиноидов, но незаменимо как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия золотом контактных поверхностей, разъёмов, печатных плат используются очень широко.
Золото используется в качестве мишени в ядерных исследованиях, в качестве покрытия зеркал, в качестве специальной оболочки в нейтронной бомбе. Тонкий слой золота на внутренней поверхности оконных и витражных стекол существенно уменьшает нежелательные тепловые потери зимой.
Золочение металлов широко используется в качестве метода защиты от коррозии. Хотя такое покрытие неблагородных металлов имеет существенные недостатки (мягкость покрытия, высокий потенциал при точечной коррозии), оно распространено также из-за того, что готовое изделие приобретает вид очень дорогого, «золотого».
Золото зарегистрировано в качестве пищевой добавки Е175.
Слайд 11В ювелирных изделиях
Традиционным и самым крупным потребителем золота является ювелирная промышленность.
Важнейшей характеристикой ювелирных изделий является их проба, характеризующая содержание в них золота.
В стоматологии
Значительные количества золота потребляет стоматология: коронки и зубные протезы изготовляют из сплавов золота с серебром, медью, никелем, платиной, цинком. Такие сплавы сочетают коррозионную стойкость с высокими механическими свойствами.
В фармакологии
Соединения золота входят в состав некоторых медицинских препаратов, используемых для лечения ряда заболеваний (туберкулёза, ревматоидных артритов и т. д.). Радиоактивный изотоп 198Au используется при лечении злокачественных опухолей в радиотерапии.
Слайд 12Запасы
В России
Предполагаемые золотые резервы стран мира в 2006
Основная статья: Золотой
Запасы золота в государственном резерве России в декабре 2008 г. составили 495,9 тонны (2,2 % от всех государств мира). Доля золота в общем объёме золотовалютных резервов России в марте 2006 составила 3,8 %. По состоянию на начало 2011 года Россия занимает 8 место в мире по объёму золота, находящегося в государственном резерве. В августе 2013 года Россия увеличила золотой запас до 1015 т. В 2014 и 2016 годах Россия продолжила наращивать запасы драгоценного метала, которые на середину 2016 составили 1444,5 т.
Следует учитывать, что во многих странах частные лица владеют бо́льшим объёмом золота, чем золотой запас соответствующего государства. Например, на декабрь 2011 года, граждане Индии владеют 18000 тоннами золота, при том, что государственный золотой запас в 2013 году составлял 557,7 тонны.