группа- , подгруппа-
Степень окисления +2, +3
Схема строения атома −
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Железо и его соединения
Содержание
- 1. Презентация по химии Железо и его соединения
- 2. Физические свойстваЖелезо − металл, серебристо-белого цвета, пластичное,
- 3. Получение железа Fe2O3 + H2 = Fe
- 4. Тест 11. Степень окисления железа +1 +2 +3 −22. В какой
- 5. 4. Какой элемент можно прочитать как феррум: алюминий,
- 6. Химические свойства железа +2
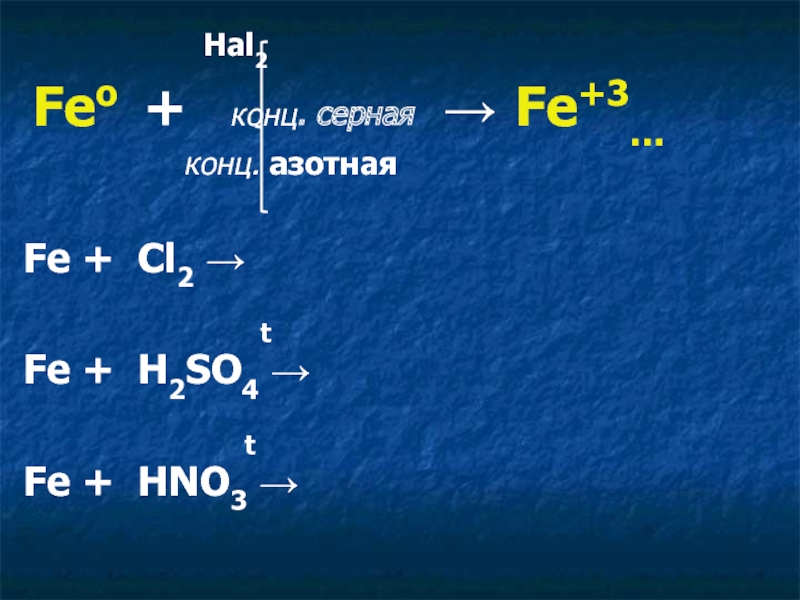
- 7. кислота разб. Feо + сера
- 8. Hal2 Feо + конц. серная
- 9. Тест 21. В каком соединении железо имеет
- 10. 4. При взаимодействии железа с какими
- 11. Соединения железа Оксиды железа +2 и +31.
- 12. Гидроксиды железа:1. FeCl2 +
- 13. Практическая работа «Получение гидроксидов железа и взаимодействие
- 14. Получение гидроксида железа Fe(OH)21.Налейте в пробирку
- 15. Получение гидроксида железа Fe(OH)31. Налейте в
- 16. Оформление работы? Какого цвета растворы солей железа?
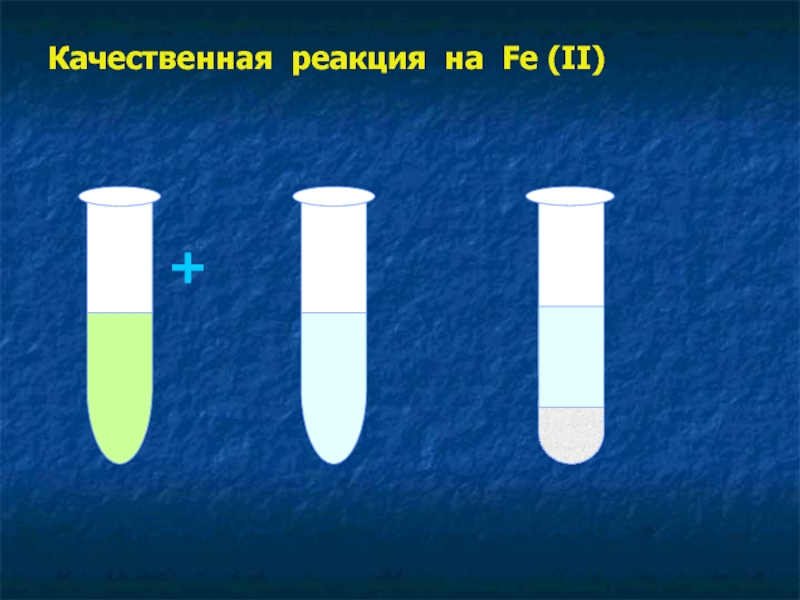
- 17. Качественная реакция на Fe (II) + =
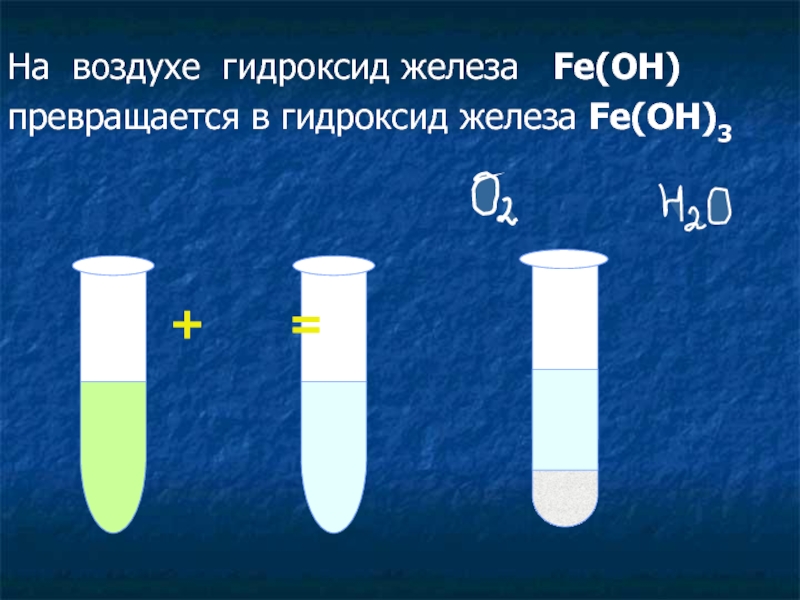
- 18. На воздухе гидроксид железа Fe(OH)превращается в гидроксид железа Fe(OH)3 + =
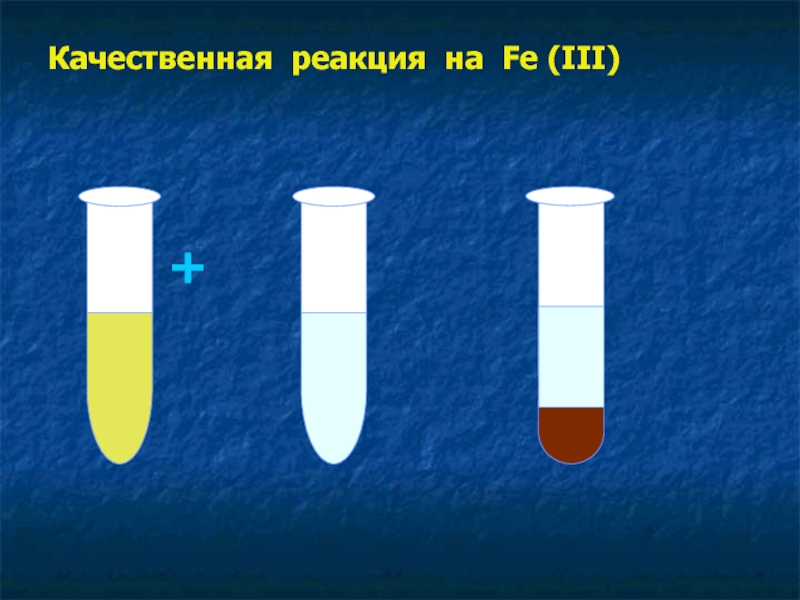
- 19. Качественная реакция на Fe (III) + =
- 20. Тест:
Физические свойстваЖелезо − металл, серебристо-белого цвета, пластичное, притягивается магнитом. При t = 15000 железо плавится и превращается в жидкость.
Слайд 2Физические свойства
Железо − металл, серебристо-белого цвета, пластичное, притягивается магнитом. При t
= 15000 железо плавится и превращается в жидкость.
Слайд 4Тест 1
1. Степень окисления железа
+1 +2 +3 −2
2. В какой группе находится железо
а) VІІ
группа побочная подгруппа
б) VІІІ группа главная подгруппа
в) V группа побочная подгруппа
г) VІІІ группа побочная подгруппа
3. Сколько электронов на предпоследнем уровне у Fe
5 12 14 9
б) VІІІ группа главная подгруппа
в) V группа побочная подгруппа
г) VІІІ группа побочная подгруппа
3. Сколько электронов на предпоследнем уровне у Fe
5 12 14 9
Слайд 54. Какой элемент можно прочитать как феррум:
алюминий, железо, сера,
азот
5. Какие вещества используют для получения Fe
О2 Fe2O3 H2O H2
6. Какие вещества ещё образуются при получении Fe
Al2O3 Al Fe3O4 H2O
5. Какие вещества используют для получения Fe
О2 Fe2O3 H2O H2
6. Какие вещества ещё образуются при получении Fe
Al2O3 Al Fe3O4 H2O
Слайд 6
Химические свойства железа
+2 FeO Fe(OH)2 FeCl2. ……
+3
Fe2O3 Fe(OH)3 FeCl3, ……
Горение: Fe + O2 → Fe3O4
Нагревание: Fe + H2O → Fe3O4 + H2
На воздухе: Fe + H2O + O2 → Fe(OH)3
FeO *Fe2O3 Fe(OH)3
Fe3O4
смешанный оксид, ржавчина
железная окалина
Горение: Fe + O2 → Fe3O4
Нагревание: Fe + H2O → Fe3O4 + H2
На воздухе: Fe + H2O + O2 → Fe(OH)3
FeO *Fe2O3 Fe(OH)3
Fe3O4
смешанный оксид, ржавчина
железная окалина
Слайд 9Тест 2
1. В каком соединении железо имеет степень окисления +2
Fe2O3 FeО
Fe(OH)2 FeF3 Fe(NO3)2
2. В каком соединении железо имеет степень окисления +3
Fe2O3 FeО Fe(OH)3 FeF3 Fe2(SO4)3
3. Что−железная окалина, а что - ржавчина
Fe2O3 Fe(OH)2 Fe(OH)3 Fe3О4 Fe2(SO4)3
… + … = Fe3О4
… + … + … = Fe(OH)3
2. В каком соединении железо имеет степень окисления +3
Fe2O3 FeО Fe(OH)3 FeF3 Fe2(SO4)3
3. Что−железная окалина, а что - ржавчина
Fe2O3 Fe(OH)2 Fe(OH)3 Fe3О4 Fe2(SO4)3
… + … = Fe3О4
… + … + … = Fe(OH)3
Слайд 10 4. При взаимодействии железа с какими веществами образуется Fe+2
S конц.H2SO4 разб.H2SO4 AgNO3 O2
5. При взаимодействии железа с какими веществами образуется Fe+3
конц.H2SO4 разб. H2SO4 конц. H2SO4(tо)
6. Взаимодействием каких веществ образуется «ржавчина»
а) Железо, вода
б) железо, вода, кислород
в) железо, кислород
Слайд 11
Соединения железа
Оксиды железа +2 и +3
1. Fe2O3 +
СО = FeO + СО2
2. Fe(OH)3 = Fe2O3 + Н2О
3. ….. + …… = Fe3О4
Соли железа:
+2 растворы зеленоватого цвета
+3 растворы жёлтого цвета
2. Fe(OH)3 = Fe2O3 + Н2О
3. ….. + …… = Fe3О4
Соли железа:
+2 растворы зеленоватого цвета
+3 растворы жёлтого цвета
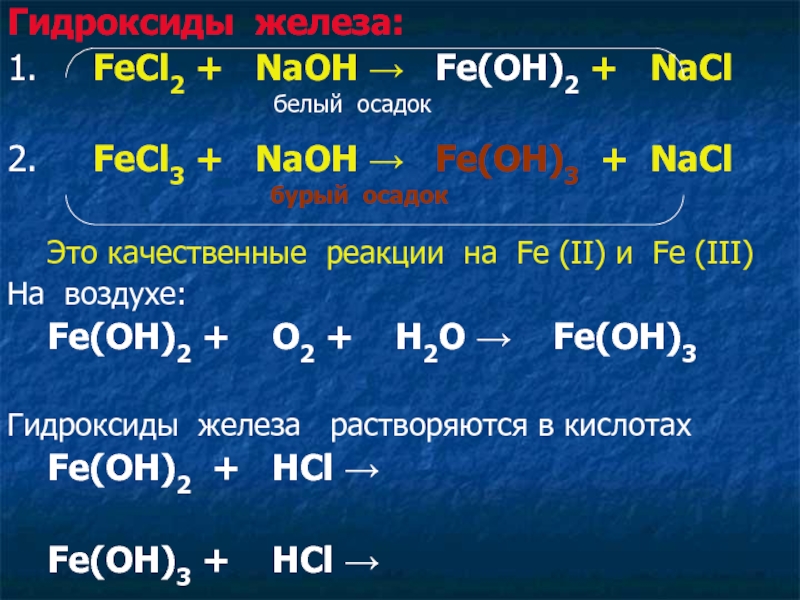
Слайд 12Гидроксиды железа:
1. FeCl2 + NaOH → Fe(OH)2
+ NaCl
белый осадок
2. FeCl3 + NaOH → Fe(OH)3 + NaCl
бурый осадок
Это качественные реакции на Fe (II) и Fe (III)
На воздухе:
Fe(OH)2 + O2 + H2O → Fe(OH)3
Гидроксиды железа растворяются в кислотах
Fe(OH)2 + HCl →
Fe(OH)3 + HCl →
белый осадок
2. FeCl3 + NaOH → Fe(OH)3 + NaCl
бурый осадок
Это качественные реакции на Fe (II) и Fe (III)
На воздухе:
Fe(OH)2 + O2 + H2O → Fe(OH)3
Гидроксиды железа растворяются в кислотах
Fe(OH)2 + HCl →
Fe(OH)3 + HCl →
Слайд 13Практическая работа
«Получение гидроксидов железа и взаимодействие их с кислотами.
Цель: Изучение
свойств металлов и их соединений. Обнаружение Fe+2 и Fe+3 в растворе.
Оборудование:
Пробирки, мерный цилиндр
Реактивы:
соли железа, гидроксид натрия,
соляная кислота, серная кислота
Оборудование:
Пробирки, мерный цилиндр
Реактивы:
соли железа, гидроксид натрия,
соляная кислота, серная кислота
Слайд 14Получение гидроксида железа Fe(OH)2
1.Налейте в пробирку 2-3 мл сульфата
железа (ІІ)
2. Добавьте немного гидроксида натрия
3. К полученному осадку добавьте немного соляной кислоты
2. Добавьте немного гидроксида натрия
3. К полученному осадку добавьте немного соляной кислоты
Слайд 15Получение гидроксида железа Fe(OH)3
1. Налейте в пробирку 2-3 мл хлорида
железа (ІІІ)
2. Добавьте немного гидроксида натрия
3. К полученному осадку добавьте немного серной кислоты.
2. Добавьте немного гидроксида натрия
3. К полученному осадку добавьте немного серной кислоты.
Слайд 16Оформление работы
? Какого цвета растворы солей железа
? Как получают гидроксид железа
(ІІ) и гидроксид железа (ІІІ)
? Какого цвета полученные осадки
?Какие вещества образуются при взаимодействии этих осадков с кислотой
? Напишите молекулярные, ионные и сокращённые ионные уравнения
?Как можно определить ионы Fe+2 и Fe+3
? Какой из этапов практической работы является качественной реакцией на ион Fe+2 и Fe+3
? Какого цвета полученные осадки
?Какие вещества образуются при взаимодействии этих осадков с кислотой
? Напишите молекулярные, ионные и сокращённые ионные уравнения
?Как можно определить ионы Fe+2 и Fe+3
? Какой из этапов практической работы является качественной реакцией на ион Fe+2 и Fe+3