учитель химии МОБУ СОШ №8,
г. Волхов Ленинградской области
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Задания 30 и 31 из ЕГЭ 2019 года
Содержание
- 1. Презентация по химии Задания 30 и 31 из ЕГЭ 2019 года
- 2. Задание 30 Из предложенного перечня
- 3. Задание 31Из предложенного перечня веществ выберите вещества,
- 4. Реальный ЕГЭ 2019. Задание 30. Вариант 1. Азотная
- 5. Реальный ЕГЭ 2019. Задание 31. Вариант
- 6. Реальный ЕГЭ 2019. Задание 30. Вариант 2
- 7. Реальный ЕГЭ 2019. Задание 31. Вариант 2
- 8. Реальный ЕГЭ 2019. Задание 30. Вариант 3
- 9. Реальный ЕГЭ 2019. Задание 31. Вариант 3
- 10. Реальный ЕГЭ 2019. Задание 30. Вариант 4
- 11. Реальный ЕГЭ 2019. Задание 31. Вариант 4
- 12. Реальный ЕГЭ 2019. Задание 30. Вариант 5
- 13. Реальный ЕГЭ 2019. Задание 31. Вариант 5
- 14. Реальный ЕГЭ 2019. Задание 30. Вариант 6
- 15. Реальный ЕГЭ 2019. Задание 31. Вариант 6
- 16. Реальный ЕГЭ 2019. Задание 30. Вариант 7
- 17. Реальный ЕГЭ 2019. Задание 31. Вариант 7
- 18. Реальный ЕГЭ 2019. Задание 30. Вариант 8
- 19. Реальный ЕГЭ 2019. Задание 31. Вариант 8
- 20. Реальный ЕГЭ 2019. Задание 30. Вариант 9
- 21. Реальный ЕГЭ 2019. Задание 31. Вариант 9
- 22. Реальный ЕГЭ 2019. Задание 30. Вариант 10
- 23. Реальный ЕГЭ 2019. Задание 31. Вариант 10
- 24. Реальный ЕГЭ 2019. Задание 30. Вариант 11
- 25. Реальный ЕГЭ 2019. Задание 31. Вариант 11
- 26. Реальный ЕГЭ 2019. Задание 30. Вариант 12
- 27. Реальный ЕГЭ 2019. Задание 31. Вариант 12 Карбонат
- 28. Реальный ЕГЭ 2019. Задание
- 29. Реальный ЕГЭ 2019. Задание 31. Вариант 13
- 30. Реальный ЕГЭ 2019. Задание 30. Вариант 14 Гидроксид
- 31. Реальный ЕГЭ 2019. Задание 31. Вариант 14
Задание 30 Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Слайд 2 Задание 30
Из предложенного перечня веществ выберите вещества, между которыми может
протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции. Дан следующий перечень веществ (допустимо использование водных растворов) — смотри ниже.
Слайд 3Задание 31
Из предложенного перечня веществ выберите вещества, между которыми может протекать
реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций. Дан следующий перечень веществ (смотри ниже).
Слайд 4Реальный ЕГЭ 2019. Задание 30. Вариант 1.
Азотная кислота, сульфат меди(II), ацетат магния,
фосфин, хлороводород.
Решение:
PH3 + HNO3 → H3PO4 + NO2 +H2O
PH3 +8 HNO3 = H3PO4 +8 NO2 +4H2O
1 P-3 – 8e = P+5
8 N+5 + 1e = N+4
P-3 , PH3- восстановитель
N+5 , HNO3 - окислитель
Решение:
PH3 + HNO3 → H3PO4 + NO2 +H2O
PH3 +8 HNO3 = H3PO4 +8 NO2 +4H2O
1 P-3 – 8e = P+5
8 N+5 + 1e = N+4
P-3 , PH3- восстановитель
N+5 , HNO3 - окислитель
Слайд 5
Реальный ЕГЭ 2019. Задание 31. Вариант 1
Азотная кислота, сульфат меди(II), ацетат магния,
фосфин, хлороводород.
Решение:
(CH3COO)2Mg + 2HCl = MgCl2 + 2CH3COOH
2CH3COO— + Mg2+ + 2H+ + 2Cl— = Mg2+ + 2Cl— + 2CH3COOH
CH3COO— + H+ = CH3COOH
Решение:
(CH3COO)2Mg + 2HCl = MgCl2 + 2CH3COOH
2CH3COO— + Mg2+ + 2H+ + 2Cl— = Mg2+ + 2Cl— + 2CH3COOH
CH3COO— + H+ = CH3COOH
Слайд 6
Реальный ЕГЭ 2019. Задание 30. Вариант 2
Сульфид серебра(I), азотная кислота, сульфат аммония,
нитрат железа(III), ацетат стронция.
Решение:
Ag2S + HNO3 → AgNO3 + H2SO4 + NO2 + H2O
(реакция протекает в горячей концентрированной кислоте)
Ag2S + 10HNO3 = 2AgNO3 + H2SO4 + 8NO2 + 4H2O
1 S-2 – 8e = S+6
8 N+5 + 1e = N+4
S-2 , Ag2S – восстановитель
N+5, HNO3- окислитель
Возможны и другие варианты этой же реакции.
Решение:
Ag2S + HNO3 → AgNO3 + H2SO4 + NO2 + H2O
(реакция протекает в горячей концентрированной кислоте)
Ag2S + 10HNO3 = 2AgNO3 + H2SO4 + 8NO2 + 4H2O
1 S-2 – 8e = S+6
8 N+5 + 1e = N+4
S-2 , Ag2S – восстановитель
N+5, HNO3- окислитель
Возможны и другие варианты этой же реакции.
Слайд 7
Реальный ЕГЭ 2019. Задание 31. Вариант 2
Сульфид серебра(I), азотная кислота, сульфат аммония,
нитрат железа(III), ацетат стронция.
Решение:
(NH4)2SO4 + (CH3COO)2Sr = SrSO4↓ + 2CH3COONH4
2NH4+ + SO42- + 2CH3COO— + Sr2+ = SrSO4↓ + 2CH3COO— + 2NH4+
Sr2+ + SO42- = SrSO4↓
Решение:
(NH4)2SO4 + (CH3COO)2Sr = SrSO4↓ + 2CH3COONH4
2NH4+ + SO42- + 2CH3COO— + Sr2+ = SrSO4↓ + 2CH3COO— + 2NH4+
Sr2+ + SO42- = SrSO4↓
Слайд 8
Реальный ЕГЭ 2019. Задание 30. Вариант 3
Ацетат аммония, нитрат цинка, фосфин, оксид
серы(IV), серная кислота.
Решение:
PH3 + H2SO4→ H3PO4 + SO2 + H2O
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
1 P-3 – 8e = P+5
4 S+6 + 2e = S+4
PH3 - восстановитель
S+6, H2SO4 - окислитель
Решение:
PH3 + H2SO4→ H3PO4 + SO2 + H2O
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
1 P-3 – 8e = P+5
4 S+6 + 2e = S+4
PH3 - восстановитель
S+6, H2SO4 - окислитель
Слайд 9
Реальный ЕГЭ 2019. Задание 31. Вариант 3
Ацетат аммония, нитрат цинка, фосфин, оксид
серы(IV), серная кислота.
Решение:
2CH3COONH4 + H2SO4 = (NH4)2SO4 + 2CH3COOH
2CH3COO— + 2NH4+ + 2H+ + SO42- = 2NH4+ + SO42- + 2CH3COOH
CH3COO— + H+ = CH3COOH
Решение:
2CH3COONH4 + H2SO4 = (NH4)2SO4 + 2CH3COOH
2CH3COO— + 2NH4+ + 2H+ + SO42- = 2NH4+ + SO42- + 2CH3COOH
CH3COO— + H+ = CH3COOH
Слайд 10
Реальный ЕГЭ 2019. Задание 30. Вариант 4
Хлорат калия, гидроксид калия, оксид хрома(III),
ацетат меди(II), оксид меди(II).
Решение:
Cr2O3 + KClO3 + KOH → K2CrO4 + KCl + H2O
Cr2O3 + KClO3 + 4KOH = 2K2CrO4 + KCl + 2H2O
1 2Cr+3 – 6e = 2Cr+6
1 Cl+5 + 6e = Cl-1
Cr+3 , Cr2O3 - восстановитель
Cr2O3 , KClO3 - окислитель
Решение:
Cr2O3 + KClO3 + KOH → K2CrO4 + KCl + H2O
Cr2O3 + KClO3 + 4KOH = 2K2CrO4 + KCl + 2H2O
1 2Cr+3 – 6e = 2Cr+6
1 Cl+5 + 6e = Cl-1
Cr+3 , Cr2O3 - восстановитель
Cr2O3 , KClO3 - окислитель
Слайд 11
Реальный ЕГЭ 2019. Задание 31. Вариант 4
Хлорат калия, гидроксид калия, оксид хрома(III),
ацетат меди(II), оксид меди(II).
Решение:
2KOH + (CH3COO)2Cu = Cu(OH)2↓ + 2CH3COOK
2K+ + 2OH— + 2CH3COO— + Cu2+ = Cu(OH)2↓ + 2CH3COO— + 2K+
Cu2+ + 2OH— = Cu(OH)2↓
Решение:
2KOH + (CH3COO)2Cu = Cu(OH)2↓ + 2CH3COOK
2K+ + 2OH— + 2CH3COO— + Cu2+ = Cu(OH)2↓ + 2CH3COO— + 2K+
Cu2+ + 2OH— = Cu(OH)2↓
Слайд 12
Реальный ЕГЭ 2019. Задание 30. Вариант 5
Гипохлорит калия, оксид хрома(III), гидроксид калия,
сульфат железа(III), оксид магния.
Решение:
Cr2O3 + KClO + KOH → K2CrO4 + KCl + H2O
Cr2O3 + 3KClO + 4KOH = 2K2CrO4 + 3KCl + 2H2O
1 2Cr+3 – 6e = 2Cr+6
3 Cl+1 + 2e = Cl-1
Cr+3 , Cr2O3 - восстановитель
Cl+1 , KClO - окислитель
Решение:
Cr2O3 + KClO + KOH → K2CrO4 + KCl + H2O
Cr2O3 + 3KClO + 4KOH = 2K2CrO4 + 3KCl + 2H2O
1 2Cr+3 – 6e = 2Cr+6
3 Cl+1 + 2e = Cl-1
Cr+3 , Cr2O3 - восстановитель
Cl+1 , KClO - окислитель
Слайд 13
Реальный ЕГЭ 2019. Задание 31. Вариант 5
Гипохлорит калия, оксид хрома(III), гидроксид калия,
сульфат железа(III), оксид магния.
Решение:
6KOH + Fe2(SO4)3 = 2Fe(OH)3↓ + 3K2SO4
6K+ + 6OH— + 2Fe3+ + 3SO42- = 2Fe(OH)3↓ + 6K+ + 3SO42-
Fe3+ + 3OH— = Fe(OH)3↓
Решение:
6KOH + Fe2(SO4)3 = 2Fe(OH)3↓ + 3K2SO4
6K+ + 6OH— + 2Fe3+ + 3SO42- = 2Fe(OH)3↓ + 6K+ + 3SO42-
Fe3+ + 3OH— = Fe(OH)3↓
Слайд 14
Реальный ЕГЭ 2019. Задание 30. Вариант 6
Сульфат железа(II), оксид марганца(IV), серная кислота,
ацетат магния, нитрит аммония.
Решение:
FeSO4 + MnO2 + H2SO4 = MnSO4 + Fe2(SO4)3 + H2O
2FeSO4 + MnO2 + 2H2SO4 = MnSO4 + Fe2(SO4)3 + 2H2O
1 2Fe+2 — 2e = 2Fe+3
1 Mn+4 + 2e = Mn+2
Fe+2, FeSO4 – восстановитель; Mn+4, MnO2- окислитель
Второй вариант:
NH4NO2 + MnO2 + H2SO4 = MnSO4 + NH4NO3+H2O
1 N+3 – 2e = N+5
1 Mn+4 + 2e = Mn+2
N+3 , NH4NO2- восстановитель; Mn+4 , MnO2- окислитель
Решение:
FeSO4 + MnO2 + H2SO4 = MnSO4 + Fe2(SO4)3 + H2O
2FeSO4 + MnO2 + 2H2SO4 = MnSO4 + Fe2(SO4)3 + 2H2O
1 2Fe+2 — 2e = 2Fe+3
1 Mn+4 + 2e = Mn+2
Fe+2, FeSO4 – восстановитель; Mn+4, MnO2- окислитель
Второй вариант:
NH4NO2 + MnO2 + H2SO4 = MnSO4 + NH4NO3+H2O
1 N+3 – 2e = N+5
1 Mn+4 + 2e = Mn+2
N+3 , NH4NO2- восстановитель; Mn+4 , MnO2- окислитель
Слайд 15
Реальный ЕГЭ 2019. Задание 31. Вариант 6
Сульфат железа(II), оксид марганца(IV), серная кислота,
ацетат магния, нитрит аммония.
Решение:
(CH3COO)2Mg + H2SO4 = MgSO4 + 2CH3COOH
2CH3COO—+ Mg2++2H+ +SO42- = Mg2++ SO42-+2CH3COOH
CH3COO— + H+ = CH3COOH
Решение:
(CH3COO)2Mg + H2SO4 = MgSO4 + 2CH3COOH
2CH3COO—+ Mg2++2H+ +SO42- = Mg2++ SO42-+2CH3COOH
CH3COO— + H+ = CH3COOH
Слайд 16
Реальный ЕГЭ 2019. Задание 30. Вариант 7
Перманганат натрия, сульфид натрия, ацетат стронция,
нитрат лития, гидрокарбонат натрия.
Решение:
NaMnO4 + Na2S + H2O → MnO2 + S + NaOH
2NaMnO4 + 3Na2S + 4H2O = 2MnO2 + 3S + 8NaOH
2 Mn+7 + 3e = Mn+4
3 S-2 – 2e = S0
Mn+7, NaMnO4 - окислитель
S-2 , Na2S - восстановитель
Решение:
NaMnO4 + Na2S + H2O → MnO2 + S + NaOH
2NaMnO4 + 3Na2S + 4H2O = 2MnO2 + 3S + 8NaOH
2 Mn+7 + 3e = Mn+4
3 S-2 – 2e = S0
Mn+7, NaMnO4 - окислитель
S-2 , Na2S - восстановитель
Слайд 17
Реальный ЕГЭ 2019. Задание 31. Вариант 7
Перманганат натрия, сульфид натрия, ацетат стронция,
нитрат лития, гидрокарбонат натрия.
Решение:
Na2S + (CH3COO)2Sr = SrS↓ + 2CH3COONa
2Na+ + S2- + 2CH3COO— + Sr2+ = SrS↓ + 2CH3COO— + 2Na+
Sr2+ + S2- = SrS↓
Решение:
Na2S + (CH3COO)2Sr = SrS↓ + 2CH3COONa
2Na+ + S2- + 2CH3COO— + Sr2+ = SrS↓ + 2CH3COO— + 2Na+
Sr2+ + S2- = SrS↓
Слайд 18
Реальный ЕГЭ 2019. Задание 30. Вариант 8
Перманганат калия, иодид калия, фторид серебра,
ацетат магния, нитрат аммония.
Решение:
KMnO4 + KI + H2O = MnO2 + I2 + KOH
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2 Mn+7 + 3e = Mn+4
3 2I— – 2e = I20
Mn+4, KMnO4 - окислитель
I— , KI - восстановитель
Решение:
KMnO4 + KI + H2O = MnO2 + I2 + KOH
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2 Mn+7 + 3e = Mn+4
3 2I— – 2e = I20
Mn+4, KMnO4 - окислитель
I— , KI - восстановитель
Слайд 19
Реальный ЕГЭ 2019. Задание 31. Вариант 8
Перманганат калия, иодид калия, фторид серебра,
ацетат магния, нитрат аммония.
Решение:
2AgF + (CH3COO)2Mg = MgF2↓ + 2CH3COOAg
2Ag+ + 2F— + 2CH3COO— + Mg2+ = MgF2↓ + 2CH3COO— + 2Ag+
Mg2+ + 2F— = MgF2↓
Решение:
2AgF + (CH3COO)2Mg = MgF2↓ + 2CH3COOAg
2Ag+ + 2F— + 2CH3COO— + Mg2+ = MgF2↓ + 2CH3COO— + 2Ag+
Mg2+ + 2F— = MgF2↓
Слайд 20
Реальный ЕГЭ 2019. Задание 30. Вариант 9
Пероксид водорода, серная кислота, перманганат калия,
нитрат аммония, ацетат меди(II).
Решение:
H2O2 + KMnO4 + H2SO4 = O2 + MnSO4 + K2SO4 +H2O
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 +K2SO4 +8H2O
5 2O-1 – 2e = O20
2 Mn+7 + 5e = Mn+2
O-1 , H2O2 - восстановитель
Mn+7, KMnO4 - окислитель
Решение:
H2O2 + KMnO4 + H2SO4 = O2 + MnSO4 + K2SO4 +H2O
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 +K2SO4 +8H2O
5 2O-1 – 2e = O20
2 Mn+7 + 5e = Mn+2
O-1 , H2O2 - восстановитель
Mn+7, KMnO4 - окислитель
Слайд 21
Реальный ЕГЭ 2019. Задание 31. Вариант 9
Пероксид водорода, серная кислота, перманганат калия,
нитрат аммония, ацетат меди(II).
Решение:
(CH3COO)2Cu + H2SO4 = CuSO4 + 2CH3COOH
2CH3COO— + Cu2+ + 2H+ + SO42- = Cu2+ + SO42- + 2CH3COOH
CH3COO— + H+ = CH3COOH
Решение:
(CH3COO)2Cu + H2SO4 = CuSO4 + 2CH3COOH
2CH3COO— + Cu2+ + 2H+ + SO42- = Cu2+ + SO42- + 2CH3COOH
CH3COO— + H+ = CH3COOH
Слайд 22
Реальный ЕГЭ 2019. Задание 30. Вариант 10
Гипохлорит калия, гидроксид калия, ацетат аммония,
хлорид хрома(III), оксид серебра(I).
Решение:
CrCl3 + KClO + KOH = K2CrO4 + KCl + H2O
2CrCl3 + 3KClO + 10KOH = 2K2CrO4 + 9KCl + 5H2O
2 Cr+3 – 3e = Cr+6
3 Cl+1 + 2e = Cl-1
Cr+3, CrCl3 - восстановитель
Cl+1, KClO - окислитель
Решение:
CrCl3 + KClO + KOH = K2CrO4 + KCl + H2O
2CrCl3 + 3KClO + 10KOH = 2K2CrO4 + 9KCl + 5H2O
2 Cr+3 – 3e = Cr+6
3 Cl+1 + 2e = Cl-1
Cr+3, CrCl3 - восстановитель
Cl+1, KClO - окислитель
Слайд 23
Реальный ЕГЭ 2019. Задание 31. Вариант 10
Гипохлорит калия, гидроксид калия, ацетат аммония,
хлорид хрома(III), оксид серебра(I).
Решение:
KOH + CH3COONH4 = NH3↑ + H2O + CH3COOK
K++ OH—+ CH3COO—+ NH4+ = NH3↑ + H2O+ CH3COO— + K+
NH4+ + OH— = NH3↑ + H2O
Решение:
KOH + CH3COONH4 = NH3↑ + H2O + CH3COOK
K++ OH—+ CH3COO—+ NH4+ = NH3↑ + H2O+ CH3COO— + K+
NH4+ + OH— = NH3↑ + H2O
Слайд 24
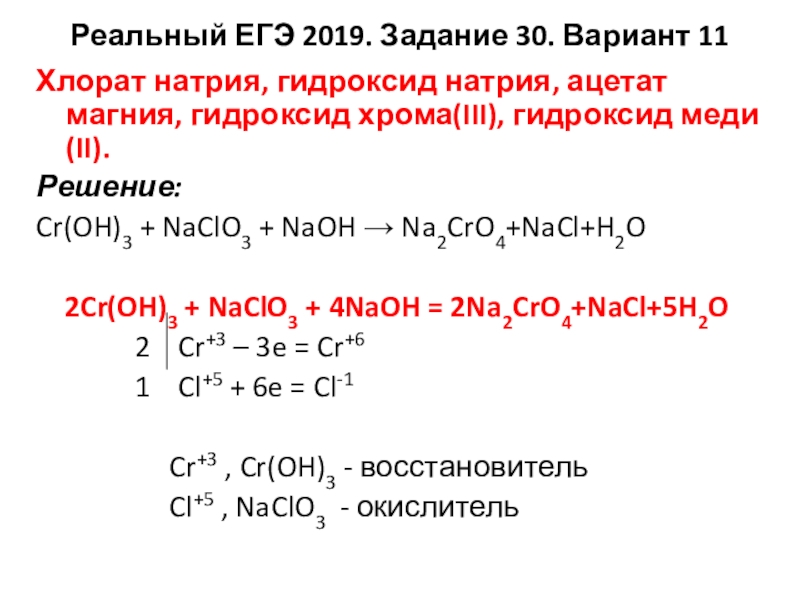
Реальный ЕГЭ 2019. Задание 30. Вариант 11
Хлорат натрия, гидроксид натрия, ацетат магния,
гидроксид хрома(III), гидроксид меди(II).
Решение:
Cr(OH)3 + NaClO3 + NaOH → Na2CrO4+NaCl+H2O
2Cr(OH)3 + NaClO3 + 4NaOH = 2Na2CrO4+NaCl+5H2O
2 Cr+3 – 3e = Cr+6
1 Cl+5 + 6e = Cl-1
Cr+3 , Cr(OH)3 - восстановитель
Cl+5 , NaClO3 - окислитель
Решение:
Cr(OH)3 + NaClO3 + NaOH → Na2CrO4+NaCl+H2O
2Cr(OH)3 + NaClO3 + 4NaOH = 2Na2CrO4+NaCl+5H2O
2 Cr+3 – 3e = Cr+6
1 Cl+5 + 6e = Cl-1
Cr+3 , Cr(OH)3 - восстановитель
Cl+5 , NaClO3 - окислитель
Слайд 25
Реальный ЕГЭ 2019. Задание 31. Вариант 11
Хлорат натрия, гидроксид натрия, ацетат магния,
гидроксид хрома(III), гидроксид меди(II).
Решение:
2NaOH + (CH3COO)2Mg = Mg(OH)2↓ + 2CH3COONa
2Na++ 2OH—+ 2CH3COO—+ Mg2+ =Mg(OH)2↓+2CH3COO— + 2Na+
Mg2+ + 2OH— = Mg(OH)2↓
Решение:
2NaOH + (CH3COO)2Mg = Mg(OH)2↓ + 2CH3COONa
2Na++ 2OH—+ 2CH3COO—+ Mg2+ =Mg(OH)2↓+2CH3COO— + 2Na+
Mg2+ + 2OH— = Mg(OH)2↓
Слайд 26
Реальный ЕГЭ 2019. Задание 30. Вариант 12
Карбонат магния, бром, гидроксид калия, нитрит
калия, гидрофосфат калия.
Решение: Br2 + KOH → KBrO3 + KBr + H2O
3Br2 + 6KOH = KBrO3 + 5KBr + 3H2O (при нагревании)
5 Br0 + 1e = Br-1
1 Br0 – 5e = Br+5
Br2 - окислитель; Br2 - восстановитель
Возможен другой вариант: KOH + Br2 → KBr + KBrO + H2O
2KOH + Br2 = KBr + KBrO + H2O
1 Br0 + 1e = Br-1
1 Br0 – 1e = Br+1
Br2 - окислитель; Br2 - восстановитель
Возможен другой вариант: KNO2 + Br2 + 2KOH → 2KBr + KNO3 + H2O
KNO2 + Br2 + 2KOH = 2KBr + KNO3 + H2O
1 N+3 – 2e = N+5
1 Br20 + 2e = 2Br-1
N+3, KNO2 - восстановитель ; Br20 - окислитель
Решение: Br2 + KOH → KBrO3 + KBr + H2O
3Br2 + 6KOH = KBrO3 + 5KBr + 3H2O (при нагревании)
5 Br0 + 1e = Br-1
1 Br0 – 5e = Br+5
Br2 - окислитель; Br2 - восстановитель
Возможен другой вариант: KOH + Br2 → KBr + KBrO + H2O
2KOH + Br2 = KBr + KBrO + H2O
1 Br0 + 1e = Br-1
1 Br0 – 1e = Br+1
Br2 - окислитель; Br2 - восстановитель
Возможен другой вариант: KNO2 + Br2 + 2KOH → 2KBr + KNO3 + H2O
KNO2 + Br2 + 2KOH = 2KBr + KNO3 + H2O
1 N+3 – 2e = N+5
1 Br20 + 2e = 2Br-1
N+3, KNO2 - восстановитель ; Br20 - окислитель
Слайд 27Реальный ЕГЭ 2019. Задание 31. Вариант 12
Карбонат магния, бром, гидроксид калия, нитрит
калия, гидрофосфат калия.
Решение:
KOH + K2HPO4 = K3PO4 + H2O
K+ + OH— + 2K+ + HPO42- = 3K+ + PO43- + H2O
OH— + HPO42- = PO43- + H2O
Решение:
KOH + K2HPO4 = K3PO4 + H2O
K+ + OH— + 2K+ + HPO42- = 3K+ + PO43- + H2O
OH— + HPO42- = PO43- + H2O
Слайд 28
Реальный ЕГЭ 2019. Задание 30. Вариант 13
Перманганат калия, фосфин, серная кислота, нитрат
лития, гидроксид железа(III).
Решение:
KMnO4 +PH3+H2SO4→H3PO4+MnSO4+K2SO4+H2O
8KMnO4 +5PH3+12H2SO4→5H3PO4+8MnSO4+4K2SO4+2H2O
8 Mn+7 + 5e = Mn+2
5 P-3 – 8e = P+5
Mn+7, KMnO4 - окислитель
P-3, PH3 - восстановитель
Решение:
KMnO4 +PH3+H2SO4→H3PO4+MnSO4+K2SO4+H2O
8KMnO4 +5PH3+12H2SO4→5H3PO4+8MnSO4+4K2SO4+2H2O
8 Mn+7 + 5e = Mn+2
5 P-3 – 8e = P+5
Mn+7, KMnO4 - окислитель
P-3, PH3 - восстановитель
Слайд 29
Реальный ЕГЭ 2019. Задание 31. Вариант 13
Перманганат калия, фосфин, серная кислота, нитрат
лития, гидроксид железа(III).
Решение:
3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O
6H+ + 3SO42- + 2Fe(OH)3 = 2Fe3+ + 3SO42- + 6H2O
3H+ + Fe(OH)3 = Fe3+ + 3H2O
Решение:
3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O
6H+ + 3SO42- + 2Fe(OH)3 = 2Fe3+ + 3SO42- + 6H2O
3H+ + Fe(OH)3 = Fe3+ + 3H2O
Слайд 30Реальный ЕГЭ 2019. Задание 30. Вариант 14
Гидроксид железа(II), гидроксид натрия, хлор, гидрофосфат
натрия, карбонат меди(II).
Решение:
Cl2 +NaOH → NaClO3 +NaCl +H2O (при нагревании)
3Cl2 + 6NaOH → NaClO3 + 5NaCl + 3H2O
5 Cl0 + 1e = Cl-1
1 Cl0 – 5e = Cl+5
Cl2 – окислитель; Cl2 - восстановитель
Возможен другой вариант:
2NaOH + Cl2 → NaCl + NaClO + H2O
1 Cl0 + 1e = Cl-1
1 Cl0 – 1e = Cl+1
Cl2 – окислитель; Cl2 - восстановитель
Возможен другой вариант:
2Fe(OH)2 + Cl2 + 2NaOH = 2Fe(OH)3 + 2NaCl
2 Fe+2 – 1e = Fe+3 восстановитель
1 Cl20 + 2e = 2Cl-1 окислитель
Fe+2 , Fe(OH)2 – восстановитель; Cl20 - окислитель
Решение:
Cl2 +NaOH → NaClO3 +NaCl +H2O (при нагревании)
3Cl2 + 6NaOH → NaClO3 + 5NaCl + 3H2O
5 Cl0 + 1e = Cl-1
1 Cl0 – 5e = Cl+5
Cl2 – окислитель; Cl2 - восстановитель
Возможен другой вариант:
2NaOH + Cl2 → NaCl + NaClO + H2O
1 Cl0 + 1e = Cl-1
1 Cl0 – 1e = Cl+1
Cl2 – окислитель; Cl2 - восстановитель
Возможен другой вариант:
2Fe(OH)2 + Cl2 + 2NaOH = 2Fe(OH)3 + 2NaCl
2 Fe+2 – 1e = Fe+3 восстановитель
1 Cl20 + 2e = 2Cl-1 окислитель
Fe+2 , Fe(OH)2 – восстановитель; Cl20 - окислитель
Слайд 31
Реальный ЕГЭ 2019. Задание 31. Вариант 14
Решение:
NaOH + Na2HPO4 = Na3PO4 + H2O
Na+ + OH— +
2Na+ + HPO42- = 3Na+ + PO43- + H2O
OH— + HPO42- = PO43- + H2O
OH— + HPO42- = PO43- + H2O
Гидроксид железа(II), гидроксид натрия, хлор, гидрофосфат натрия, карбонат меди(II).