- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии: Тестовые задания
Содержание
- 1. Презентация по химии: Тестовые задания
- 2. 1)Чем определяется место химического элемента в
- 3. 2) С увеличением порядкового номера элемента в
- 4. 3) Радиус какого атома больше: а) Na б) Mg в) Al
- 5. 4) Как изменяются химические свойства элементов в
- 6. 5) Что называется орбиталью? а) траектория, по
- 7. 6) Как изменяются свойства элементов внутри периода
- 8. 7)Как определить, используя периодическую систему химических элементов
- 9. 8)Какое число валентных электронов у атома кальция? а) 1б) 2в) 8г) 10
- 10. 9) В чём основная причина изменения свойств
- 11. 10) В чём основная причина изменения свойств
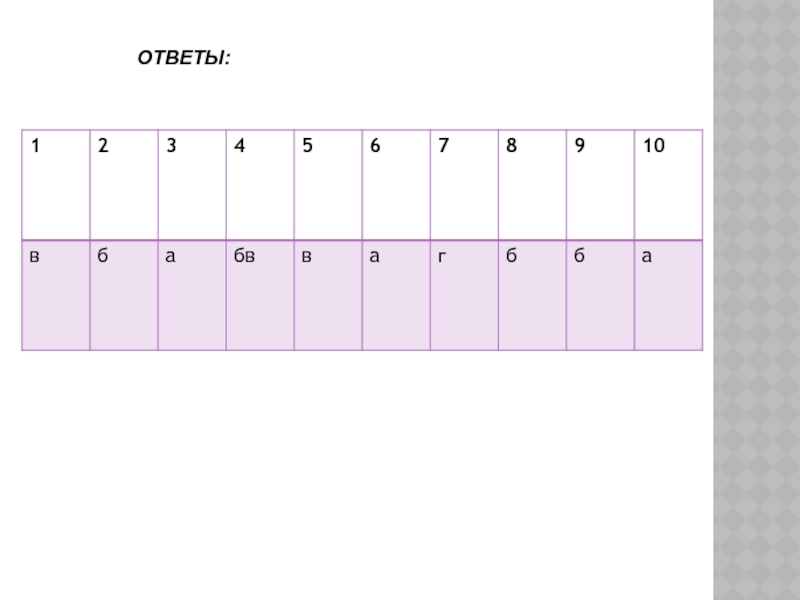
- 12. ОТВЕТЫ:
Слайд 1Тест по теме
Периодический закон. Периодическая система химических элементов Д.И. Менделеева. Строение
Слайд 2 1)Чем определяется место химического элемента в периодической системе Д.И.Менделеева
а)
в) зарядом ядра атома
Слайд 32) С увеличением порядкового номера элемента в периоде:
а) радиусы атомов увеличиваются
б)
в) радиусы атомов не изменяются
Слайд 54) Как изменяются химические свойства элементов в периоде периодической системы химических
а) усиливаются металлические свойства
б) усиливаются неметаллические свойства
в) ослабевают металлические свойства
г) ослабевают неметаллические свойства
Слайд 65) Что называется орбиталью?
а) траектория, по которой движется электрон
б) вероятность
в) пространство вокруг ядра атома, в котором наиболее вероятно пребывание электрона
г) определённый энергетический уровень, на котором находится электрон
Слайд 76) Как изменяются свойства элементов внутри периода с увеличением заряда ядер
а) плавно
б) скачкообразно
Слайд 87)Как определить, используя периодическую систему химических элементов Д.И. Менделеева, количество энергетических
а) по порядковому номеру элемента
б) по номеру группы
в) по номеру периода
Слайд 109) В чём основная причина изменения свойств химических элементов в главных
а) в постепенном увеличении атомных масс
б) в появлении нового энергетического уровня
в) в увеличении количества электронов в атоме
г) в увеличении количества нейтронов в ядре атома
Слайд 1110) В чём основная причина изменения свойств химических элементов в периоде
а) в постепенном увеличении числа электронов на внешнем энергетическом уровне
б) в увеличении атомных масс
в) в увеличении количества электронов в атоме