вдохнуть газ .Не заметив никакого эффекта, ученый решил убедиться,
проник ли газ в легкие.Он еще раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени.
Однако , …произошел взрыв
«Я думал,
что у меня вылетели все зубы вместе
с корнями»,
Какой это был газ?
Почему произошел взрыв?
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Свойства водорода 8 класс
Содержание
- 1. Презентация по химии Свойства водорода 8 класс
- 2. ВОДОРОД
- 3. Тест: общие сведения о водороде Необходимо выбрать
- 4. Определите, в каком из предложений речь
- 5. При помощи каких реакций можно получить водород,
- 6. Водород – самый распространенный химический элемент во
- 7. Получение водородаВодород можно получить из природного газа,
- 8. ТЕМА УРОКА «ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА И ЕГО ПРИМЕНЕНИЕ» Задачи:
- 9. Объясните, почему мыльные пузыри, заполненные водородом, поднимаются в вверх.
- 10. Физические свойства водородаВодород – бесцветный, самый легкий
- 11. Слайд 11
- 12. Химические свойства
- 13. Горение водорода
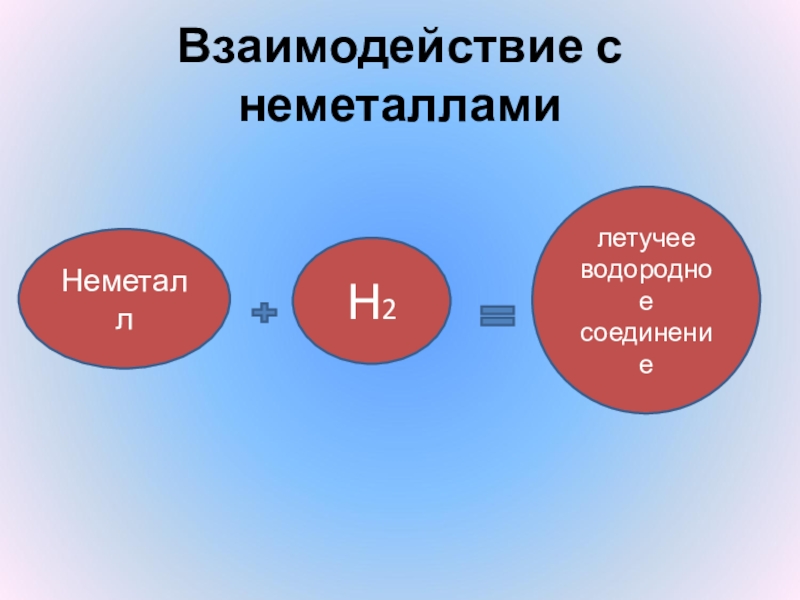
- 14. Взаимодействие с неметалламиНеметалл Н2летучее водородноесоединение
- 15. Взаимодействие с неметалламиС фтором H2 + F2
- 16. Физкультминутка
- 17. Взаимодействие с металлами2Na + H2 = 2NaH
- 18. Лабораторная работа № 6 Взаимодействие водорода с
- 19. В ходе эксперимента возникли следующие вопросы: Почему
- 20. Взаимодействие с оксидами металловН2 + CuO t
- 21. Химические свойства водорода
- 22. Предложите способы использования водорода на основании изученных свойств
- 23. Использование водорода в качестве топлива автомобилей.При сгорании водорода в кислороде образуется экологически чистый продукт – вода
- 24. Использование водорода в ракетных двигателях.Жидкий водородявляетсяраспространенным компонентом ракетного топлива
- 25. Использование водорода в металлургической промышленностиВодород как восстановитель, для получения металлов и неметаллов (кремния, вольфрама)
- 26. Сварка металла Смесь кислорода с водородом используют при сварке и резке металлов.
- 27. Синтез водородсодержащих веществСинтез аммиакаNH3Синтез хлороводорода и соляной кислотыHCl
- 28. Производство стеклаВодород является активным газом, в соединениях
- 29. В пищевой промышленностиПревращениерастительных масел в твердые жиры – маргарин
- 30. Выберите признаки, характерные для водорода1)
- 31. Составьте уравнения реакций взаимодействия водорода со следующими
- 32. Проверка выполнения задания
- 33. ДОМАШНЕЕ ЗАДАНИЕВыучить параграф 29, выполнить тестовые задания с. 101Подготовиться к практической работе № 4, с.102
- 34. Подумайте и закончите предложения: – Сегодня на
- 35. Спасибо за урок!
ВОДОРОД
Слайд 3Тест: общие сведения о водороде
Необходимо выбрать правильные утверждения. Если
вы согласны с утверждением, ставьте напротив цифры плюс, если нет, то минус.
1. Водород – самый распространённый элемент во Вселенной.
2. Относительная молекулярная масса водорода – 1 а.е.м.
3. Основным соединением водорода на нашей планете является вода.
4. Валентность водорода равна 2.
5. Формула простого вещества водорода- Н2.
Ответ: 1. + 2. - 3. + 4. - 5. +
1. Водород – самый распространённый элемент во Вселенной.
2. Относительная молекулярная масса водорода – 1 а.е.м.
3. Основным соединением водорода на нашей планете является вода.
4. Валентность водорода равна 2.
5. Формула простого вещества водорода- Н2.
Ответ: 1. + 2. - 3. + 4. - 5. +
Слайд 4Определите, в каком из предложений речь идёт о химическом элементе, а
в каком о простом веществе?
1. Водород входит в состав воды и нефти.
2. Водородом наполняют воздушные шары. 3 . Водород – самый лёгкий из всех газов.
4. Водород в земной коре в % по массе занимает 9-е место.
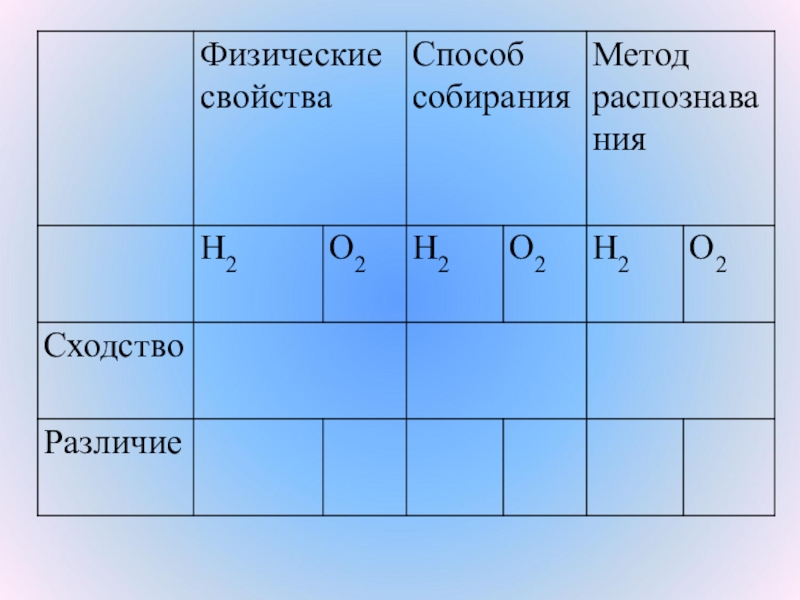
Слайд 5При помощи каких реакций можно получить водород, к какому типу относятся
эти реакции?
2) Какими методами можно собрать водород при получении?
2) Какими методами можно собрать водород при получении?
Слайд 6Водород – самый распространенный химический элемент во Вселенной, является составной частью
Солнца и звезд.
В земной коре всего 1 %.
В организме человека
содержится
60% водорода.
Входит в состав воды.
В земной коре всего 1 %.
В организме человека
содержится
60% водорода.
Входит в состав воды.
Слайд 7Получение водорода
Водород можно получить из природного газа, разложением воды, взаимодействием металлов
с кислотами, взаимодействием активных металлов с водой.
Собирают водород методом вытеснения воздуха из пробирки и методом вытеснения воды.
Собирают водород методом вытеснения воздуха из пробирки и методом вытеснения воды.
Слайд 10Физические свойства водорода
Водород – бесцветный, самый легкий газ, в 14,5 раз
легче воздуха.
Нерастворим в воде.
Имеет очень низкую температуру сжижения -252,8°С
Нерастворим в воде.
Имеет очень низкую температуру сжижения -252,8°С
Слайд 13Горение водорода
2H2 + O2= 2H2O
2 объема Н2 и 1 объем О2 – «гремучий газ»
Не шутите с Водородом!
Он горит , рождая воду,
В смеси с Кислородом- братом
Он взрывается , ребята!
Вам скажу на всякий случай –
Эту смесь зовут « гремучей».
2 объема Н2 и 1 объем О2 – «гремучий газ»
Не шутите с Водородом!
Он горит , рождая воду,
В смеси с Кислородом- братом
Он взрывается , ребята!
Вам скажу на всякий случай –
Эту смесь зовут « гремучей».
Слайд 15Взаимодействие с неметаллами
С фтором H2 + F2 = 2HF
С серой
H2 + S = H2S
С азотом 3H2 + N2 = 2NH3
С азотом 3H2 + N2 = 2NH3
Слайд 18Лабораторная работа № 6
Взаимодействие водорода с оксидом меди.
ТБ перед проведением работы:
-
проводить работу при убранных со стола лишних предметов
- внимательно прочитать инструктивную карточку
- прогреть пробирку
- работать осторожно со спиртовкой, держать наготове колпачок.
- внимательно прочитать инструктивную карточку
- прогреть пробирку
- работать осторожно со спиртовкой, держать наготове колпачок.
Слайд 19В ходе эксперимента возникли следующие вопросы:
Почему пробирку с оксидом меди (II)
закрепили под наклоном?
Почему перед нагреванием оксида меди водород надо проверить на чистоту?
Объясните, почему из черного порошка образовалось вещество красного цвета.
Какие свойства водорода подтвердил этот опыт?
Вывод: водород восстанавливает металл из его оксида
Почему перед нагреванием оксида меди водород надо проверить на чистоту?
Объясните, почему из черного порошка образовалось вещество красного цвета.
Какие свойства водорода подтвердил этот опыт?
Вывод: водород восстанавливает металл из его оксида
Слайд 20Взаимодействие с оксидами металлов
Н2 + CuO t =Н2 + CuO t
= H2O + Cu Н2 + CuO t = H2O + Cu H2O + Cu
t
Н2 + CuO = H2O + Cu
Слайд 23Использование водорода в качестве топлива автомобилей.
При сгорании водорода в кислороде образуется
экологически чистый продукт – вода
Слайд 24Использование водорода в ракетных двигателях.
Жидкий водород
является
распространенным
компонентом
ракетного топлива
Слайд 25Использование водорода в металлургической промышленности
Водород
как восстановитель, для получения металлов и
неметаллов (кремния, вольфрама)
Слайд 28Производство стекла
Водород является активным газом,
в соединениях с азотом может использоваться
в производстве листового, полого стекла и оптического волокна.
Слайд 30Выберите признаки, характерные для водорода
1) Газ, поддерживающий горение
2)
Легче воздуха
3) В лаборатории получают взаимодействием металлов с кислотами
4) Используется как восстановитель в металлургии.
5) Образует с элементами оксиды
6) Образует с металлами соединения - гидриды
7) Тяжелее воздуха
8) Образует с неметаллами летучие водородные соединения
9) Газ без цвета, вкуса, запаха, мало растворим в воде.
ответ: 2, 3, 4, 6, 8,9
3) В лаборатории получают взаимодействием металлов с кислотами
4) Используется как восстановитель в металлургии.
5) Образует с элементами оксиды
6) Образует с металлами соединения - гидриды
7) Тяжелее воздуха
8) Образует с неметаллами летучие водородные соединения
9) Газ без цвета, вкуса, запаха, мало растворим в воде.
ответ: 2, 3, 4, 6, 8,9
Слайд 31Составьте уравнения реакций взаимодействия водорода со следующими веществами:
I
Cl2 + H2 = HCl
II
Ca + H2 = Ca H
HgO + H2 = _____ + _____
Cl2 + H2 = HCl
II
Ca + H2 = Ca H
HgO + H2 = _____ + _____
Слайд 33ДОМАШНЕЕ ЗАДАНИЕ
Выучить параграф 29,
выполнить тестовые задания с. 101
Подготовиться к
практической
работе № 4, с.102
Слайд 34Подумайте и закончите предложения:
– Сегодня на уроке я узнал…
–
На уроке я понял…
– Теперь я знаю как…
– Теперь я знаю как…