- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Строение атома
Содержание
- 1. Презентация по химии Строение атома
- 2. Атом – сложная частица.В переводе с греческого «атом» означает «неделимый».
- 3. Модели строения атома.1904 г.- работа Дж.Томсона «О
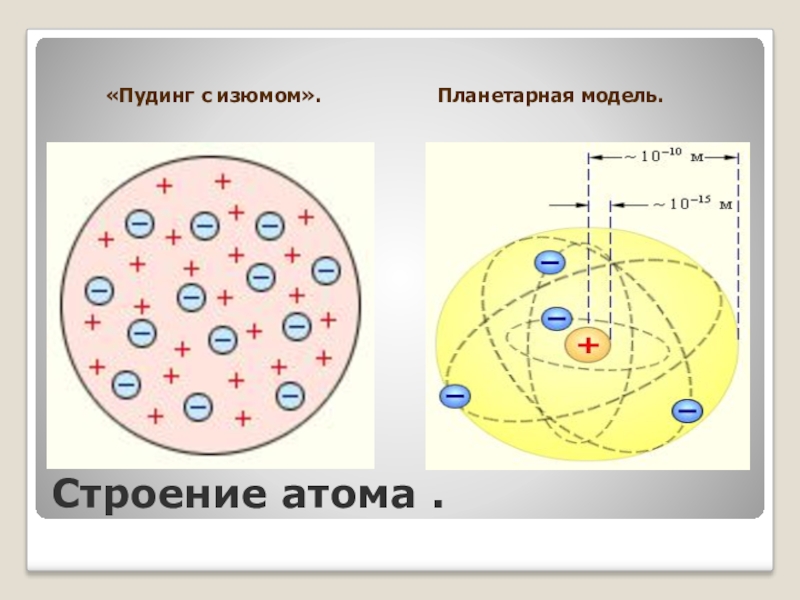
- 4. Строение атома .«Пудинг с изюмом».
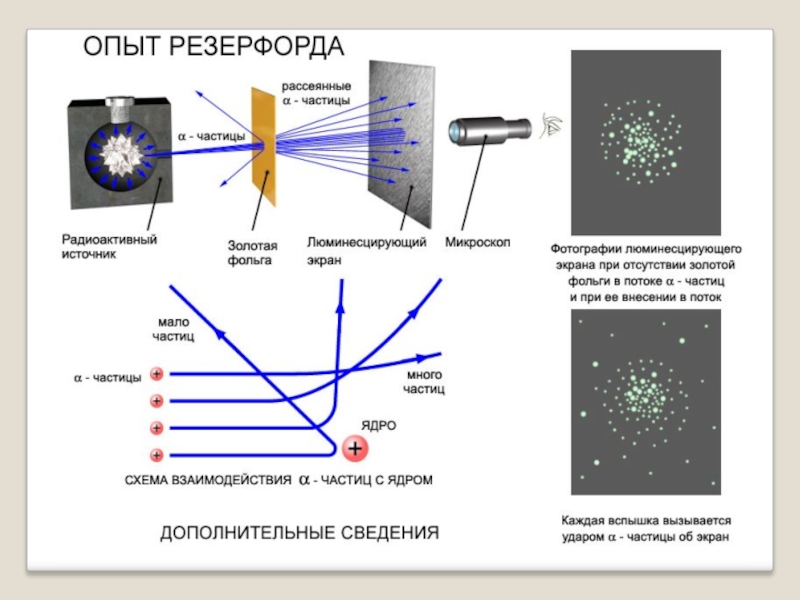
- 5. Эрнест Резерфорд
- 6. Слайд 6
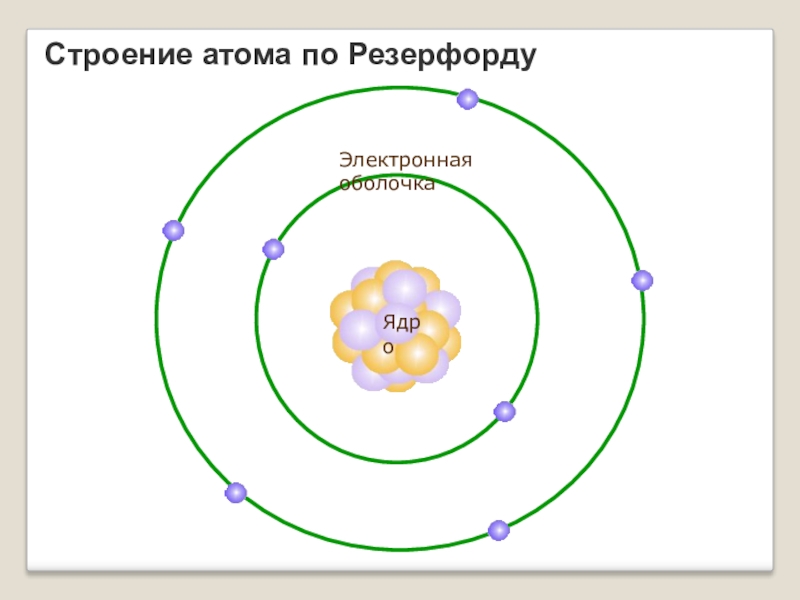
- 7. Строение атома по РезерфордуЯдроЭлектронная оболочка
- 8. Недостатки атома РезерфордаЭта модель не согласуется с
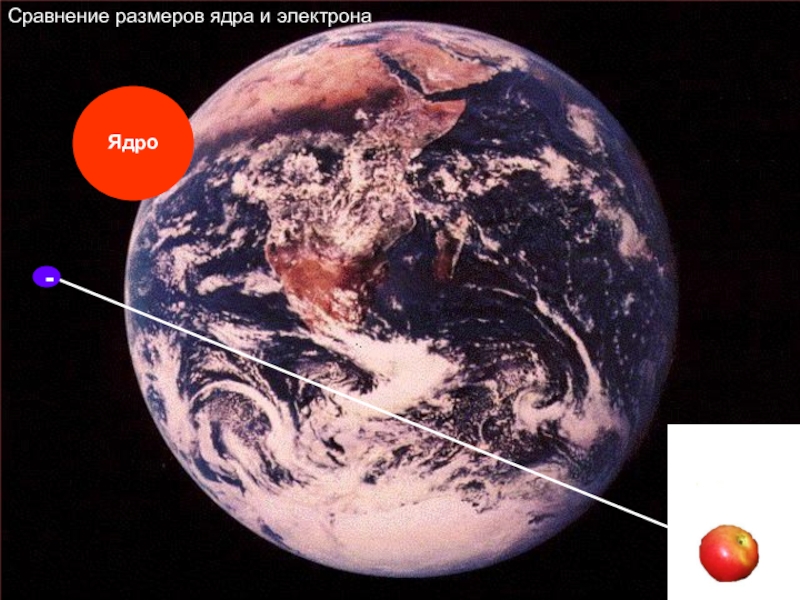
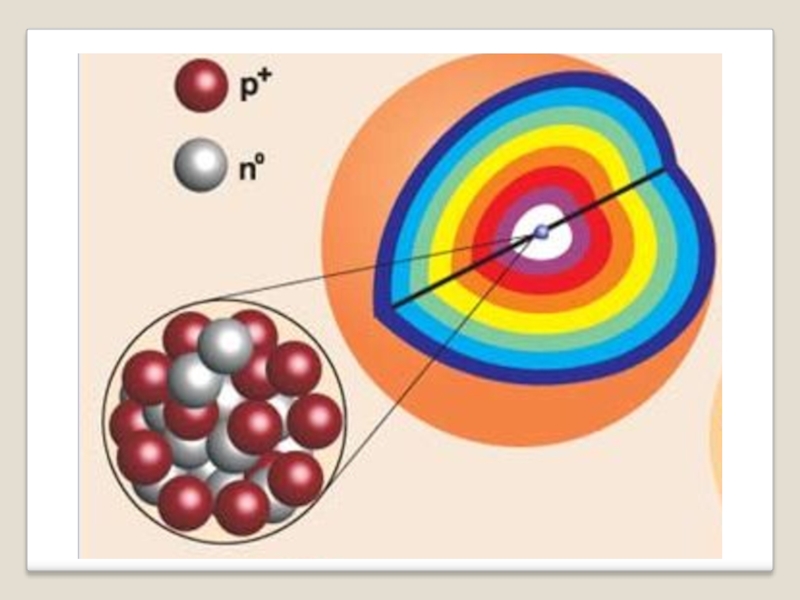
- 9. -Сравнение размеров ядра и электрона
- 10. Слайд 10
- 11. Состав ядра атомаПротоны. Масса = 1,
- 12. Электрон:Имеет двойственную природу- корпускулярно-волновой дуализм (является и
- 13. • é –
- 14. Все электроны атома образуют егоЭЛЕКТРОННУЮ ОБОЛОЧКУ ЭЛЕКТРОННАЯ
- 15. 1 уровень – s- подуровень,2 уровень –
- 16. s-подуровень 1 АО р-подуровень
- 17. Орбиталь — область пространства в атоме, в которой
- 18. Виды электронных облаков:s-,p- d- f- http://www.alhimik.ru/teleclass/konspect/konsp2-03.shtml
- 19. Слайд 19
- 20. Главное кв.число → электронный уровень.Побочное кв.число →
- 21. Принципы заполнения электронных оболочекПринцип минимальной энергии:принцип Паулиправило Хундаправило Клечковского
- 22. Принцип Паули. На одной АО могут
- 23. Правило Ф.Хунда.В пределах подуровня атомные орбитали заполняются
- 24. Правило Клечковского.При переходе от одного элемента к
- 25. Принцип наименьшей энергии.Электроны в первую очередь стремятся
- 26. Σ 1 2
- 27. «Провал» электронаВ атомах некоторых элементов электрон с
- 28. Периодическая система химических элементов и строение атома.Электронную
- 29. Структура периодической таблицы.В периодической таблице все элементы
- 30. СХЕМА СТРОЕНИЯ АТОМА Н +1 Показывает распределение электронов по уровням 1
- 31. ЭЛЕКТРОННАЯ ФОРМУЛА (КОНФИГУРАЦИЯ) АТОМА1s1Показывает распределение электронов по подуровням
- 32. ЭЛЕКТРОННО - ГРАФИЧЕСКАЯ ФОРМУЛА АТОМАПоказывает распределение электронов по АО↑
- 33. Валентные возможности атомов химических элементов. Валентность атома
- 34. Валентные электроны атомов элементов главных подгрупп расположены
- 35. Что бы верно оценить валентные возможности атомов
- 36. Атом - электронейтральная система взаимодействующих элементарных
- 37. Применение радиоактивного излучения. Биологическое действие на организм.Установка для радиотерапииА.Д.Сахаровморальный долг.
- 38. Можно погибнуть от невидимогоОсновные источники радиации:Космические телаНедра
- 39. Неуправляемая цепная ядерная реакция.Водородная бомбаАтомная бомба
- 40. Атом покорен, НО цивилизация под угрозой.Прав ли
Слайд 3Модели строения атома.
1904 г.- работа Дж.Томсона «О структуре атома».Его модель получила
1911 г.- модель атома Э.Резерфорда под названием планетарная модель атома. Самая верная модель, которой мы пользуемся и сейчас. Так же существовали другие модели строения атома.
Слайд 8Недостатки атома Резерфорда
Эта модель не согласуется с наблюдаемой стабильностью атомов. По
Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента.
К явлениям атомных масштабов законы классической физики неприменимы.
Слайд 11Состав ядра атома
Протоны.
Масса = 1, заряд = +1
Нейтроны.
Масса = 1,
Заряд ядра определяется количеством протонов
Количество протонов соответствует порядковому номеру элемента в ПСХЭ
Слайд 12Электрон:
Имеет двойственную природу- корпускулярно-волновой дуализм (является и частицей ,и волной).
Подчиняется законам
Состояние электрона в атоме определяется четырьмя квантовыми числами.
Слайд 13 • é – это частица!
m0=0,9109534*10 -27
Z=1,6021892*10 -19 Кл
é – это волна
Электрон обладает большой СКОРОСТЬЮ и ЭНЕРГИЕЙ!
частота и длина волны.
Слайд 14Все электроны атома образуют его
ЭЛЕКТРОННУЮ ОБОЛОЧКУ
ЭЛЕКТРОННАЯ ОБОЛОЧКА
ДЕЛИТСЯ НА
УРОВНИ
ИЗВЕСТНО 7 ЭНЕРГЕТИЧЕСКИХ
Слайд 151 уровень – s- подуровень,
2 уровень – s- и p- подуровни,
3
4 уровень – s-, p-, d- и f- подуровни,
5 уровень
6 уровень
7 уровень
s-, p-, d-, f- … подуровни.
Слайд 16s-подуровень 1 АО
р-подуровень 3 АО
d-подуровень
f-подуровень 7 АО
ИТАК, имеем
1s2s2p3s3p3d4s4p4d4f5s5p5d5f…
6s6p6d6f…7s7p7d7f…
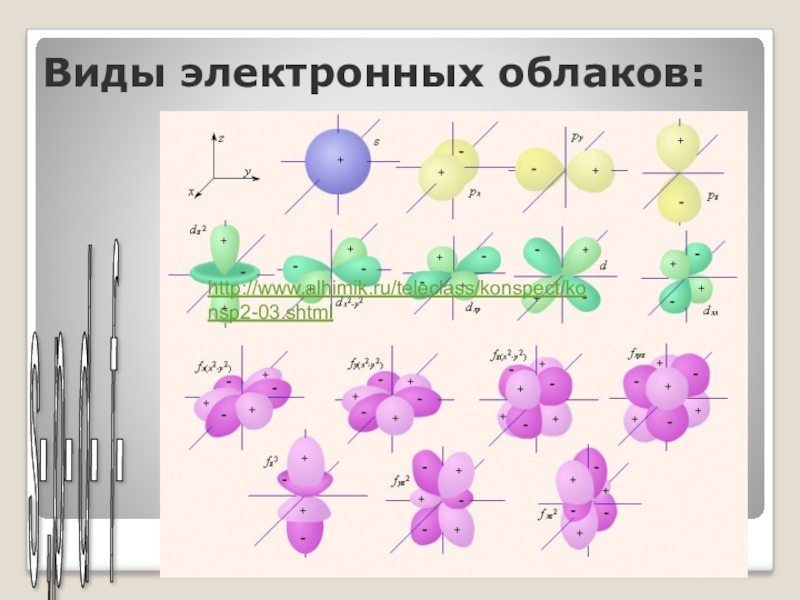
Слайд 17Орбиталь — область пространства в атоме, в которой наиболее вероятно пребывание электрона.
Каждой орбитали соответствует электронное облако. Оно имеет определенную форму и размер
Слайд 18Виды электронных облаков:
s-,p- d- f-
http://www.alhimik.ru/teleclass/konspect/konsp2-03.shtml
Слайд 20
Главное кв.число → электронный уровень.
Побочное кв.число → подуровень.
Магнитное кв.число → орбитали.
Спиновое
Вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами
Слайд 21Принципы заполнения электронных оболочек
Принцип минимальной энергии:
принцип Паули
правило Хунда
правило Клечковского
Слайд 22Принцип Паули.
На одной АО могут находиться только ДВА электрона,
↑↓
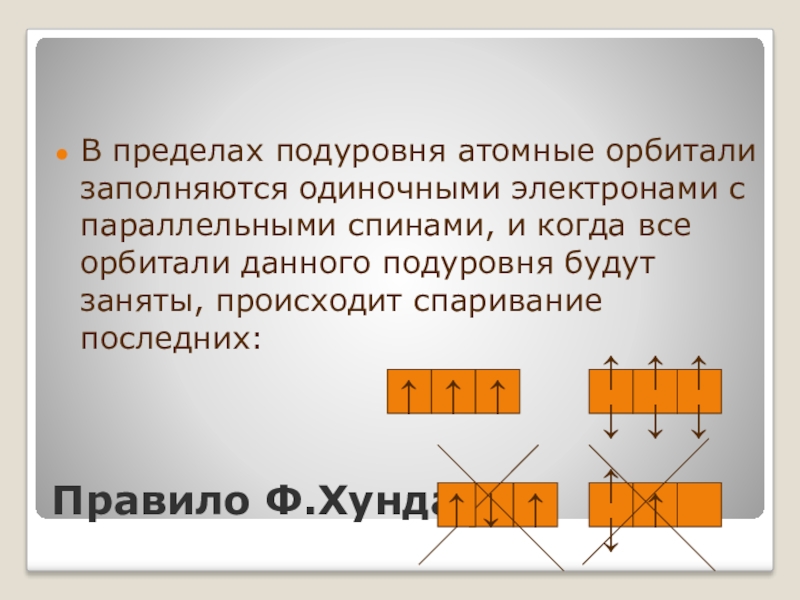
Слайд 23Правило Ф.Хунда.
В пределах подуровня атомные орбитали заполняются одиночными электронами с параллельными
↑
↑
↑
↑↓
↑↓
↑↓
↑↓
↑
↑
↓
↑
Слайд 24Правило Клечковского.
При переходе от одного элемента к другому электроны размещаются последовательно
Слайд 25Принцип наименьшей энергии.
Электроны в первую очередь стремятся занять энергетически выгодное положение
s (0), p (2), d (3), f (4)
Слайд 26Σ 1 2 3 3
1s2s2p3s3p3d4s4p4d4f5s5p5d5f…
Σ 6 7 8 9 7 8 9 10
6s6p6d6f… 7s7p7d7f…
РЯД НАИМЕНЬШЕЙ ЭНЕРГИИ:
1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p
7s5f6d7p…
Слайд 27«Провал» электрона
В атомах некоторых элементов электрон с s-подуровня внешнео энергетического уровня
Слайд 28Периодическая система химических элементов и строение атома.
Электронную формулу атома любого химического
Слайд 29 Структура периодической таблицы.
В периодической таблице все элементы расположены по возрастающим атомным
Период.
В периодах происходит заполнение электронами внешней электронной оболочки с номером n, а также незаполненной предвнешней оболочки с номером (n – 1) и (n – 2).
Группа.
В группы объединяются элементы, содержащие одинаковое число валентных электронов.
Слайд 31ЭЛЕКТРОННАЯ ФОРМУЛА (КОНФИГУРАЦИЯ) АТОМА
1s1
Показывает распределение электронов по подуровням
Слайд 33Валентные возможности атомов химических элементов.
Валентность атома химического элемента определяется в
Слайд 34Валентные электроны атомов элементов главных подгрупп расположены на s- и p-
У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предвнешнего слоёв.
Слайд 35Что бы верно оценить валентные возможности атомов химических элементов, нужно рассмотреть
Общий вывод: валентные возможности атомов химических элементов определяются:1)числом неспаренных электронов;2)наличием свободных орбиталей;3)наличием неподеленных пар электронов.
Слайд 36
Атом - электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра
Электроны, протоны и нейтроны называют элементарными частицами.
Важную роль сыграли открытия Д.И.Менделеева.
Слайд 37Применение радиоактивного излучения. Биологическое действие на организм.
Установка для радиотерапии
А.Д.Сахаров
моральный долг.
Слайд 38Можно погибнуть от невидимого
Основные источники радиации:
Космические тела
Недра Земли
Рентгеновские препараты
Телевизор и т.п.
Тело
0,01г радиоактивного калия
период распада
4000 делений в секунду
Обозначение радиации
Слайд 40Атом покорен, НО цивилизация под угрозой.
Прав ли был Прометей,
Мир рванулся вперед,
мир сорвался с пружин,
Из прекрасного лебедя
вырос дракон,
Из запретной бутылки
был выпущен джин.