- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии соляная кислота и ее свойства
Содержание
- 1. Презентация по химии соляная кислота и ее свойства
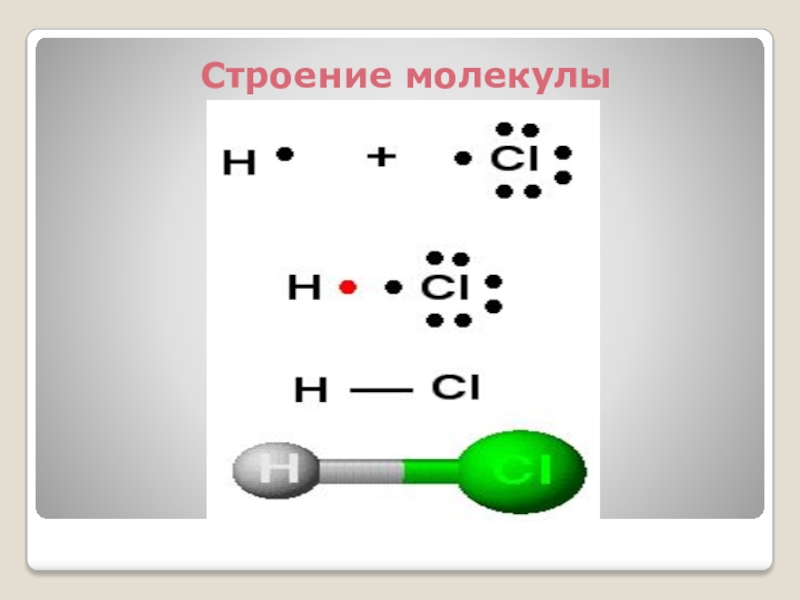
- 2. Строение молекулы
- 3. ПОЛУЧЕНИЕВ лабораторных условиях используется способ, заключающийся в
- 4. ХИМИЧЕМКИЕ СВОЙСТВАВзаимодействие с металлами, стоящими в ряду электрохимических
- 5. Взаимодействие с аммиаком с образованием густого белого дыма:NH3+HCl=NH4ClКачественной
- 6. ПРИМЕНЕНИЕПромышленность Применяется в гидрометаллургии и гальванопластике (травление,
- 7. Особенности обращенияВысококонцентрированная соляная кислота — едкое вещество, при попадании
- 8. Хлорсодержащие неорганические соединенияХлороводородная кислота (HCl) Хлорноватистая кислота (HClO)Хлористая кислота (HClO2)Хлорноватая кислота (HClO3) Хлорная кислота (HClO4)
Строение молекулы
Слайд 3ПОЛУЧЕНИЕ
В лабораторных условиях используется способ, заключающийся в действии концентрированной серной кислоты
на поваренную соль:
t 150
NaCl + H2SO4 = NaHSO4 +HCl
t 550
2NaCl +H2SO4 = Na2SO4 +HCl
t 150
NaCl + H2SO4 = NaHSO4 +HCl
t 550
2NaCl +H2SO4 = Na2SO4 +HCl
Слайд 4ХИМИЧЕМКИЕ СВОЙСТВА
Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли
и выделением газообразного водорода:
2Na+2HCl=2NaCl+H2
Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
MgO+2HCl=MgCl2+H2O
Взаимодействие с гидроксидами металлов (реакция нейтрализации):
Al(OH)3+3HCl=AlCl3+H2O
Взаимодействие с солями металлов, образованных более слабыми кислотами:
Na2CO3+2HCl=2NaCl+H2O+CO2
Взаимодействие с сильными окислителями (перманганат калия):
2KMnO4+16HCl=2MnCl2+5Cl2+2KCl+ 8H2O
2Na+2HCl=2NaCl+H2
Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
MgO+2HCl=MgCl2+H2O
Взаимодействие с гидроксидами металлов (реакция нейтрализации):
Al(OH)3+3HCl=AlCl3+H2O
Взаимодействие с солями металлов, образованных более слабыми кислотами:
Na2CO3+2HCl=2NaCl+H2O+CO2
Взаимодействие с сильными окислителями (перманганат калия):
2KMnO4+16HCl=2MnCl2+5Cl2+2KCl+ 8H2O
Слайд 5
Взаимодействие с аммиаком с образованием густого белого дыма:
NH3+HCl=NH4Cl
Качественной реакцией на соляную кислоту
и её соли является её взаимодействие с нитратом серебра при котором образуется творожистый осадок хлорида серебра:
HCl+AgNO3=AgCl+HNO3
HCl+AgNO3=AgCl+HNO3
Слайд 6ПРИМЕНЕНИЕ
Промышленность
Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности
металлов при пайке и лужении для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина
Основная статья: Кислотность желудочного сока
Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5%, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина
Основная статья: Кислотность желудочного сока
Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5%, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Слайд 7Особенности обращения
Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные
химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабой щёлочи, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15% и более - ограничен.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15% и более - ограничен.
Слайд 8Хлорсодержащие неорганические соединения
Хлороводородная кислота (HCl)
Хлорноватистая кислота (HClO)
Хлористая кислота (HClO2)
Хлорноватая
кислота (HClO3)
Хлорная кислота (HClO4)
Хлорная кислота (HClO4)