- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Соли их классификация и свойства
Содержание
- 1. Презентация по химии Соли их классификация и свойства
- 2. Соли – это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
- 3. Соли – электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы кислотных остатков.
- 4. Соли(в зависимости от входящих в состав соли
- 5. Средние солиСредние соли – это продукты полного
- 6. Средние солиAl2(SO4)3 =2Al3+2-+ 3SO4анионы кислотного остаткакатионыметаллаСвязь катионов металла с кислотным остатком слабее, чем внутри аниона.
- 7. Средние солиNH4Cl = NH4+ +Cl-Al2(SO4)3 =2Al3+ +3SO42-NaNO3 =Na+ +NO3-
- 8. Кислые солиКислые соли – это продукты неполного
- 9. Кислые солиKH2PO4 =K++ H2SO4-катионы металлаанионы кислотного остатка +
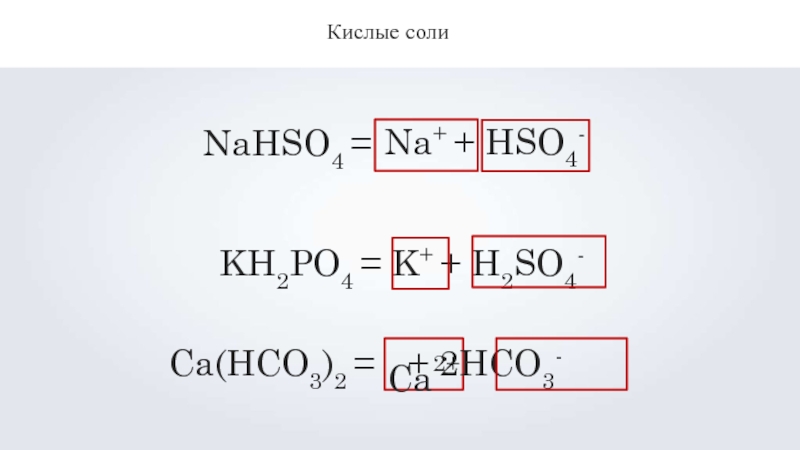
- 10. Кислые солиNaHSO4 =Na+ +HSO4-KH2PO4 = K+ + H2SO4-Ca2+Ca(HCO3)2 = + 2HCO3-
- 11. Основные солиГидроксохлорид алюминияОсновные соли – это продукты
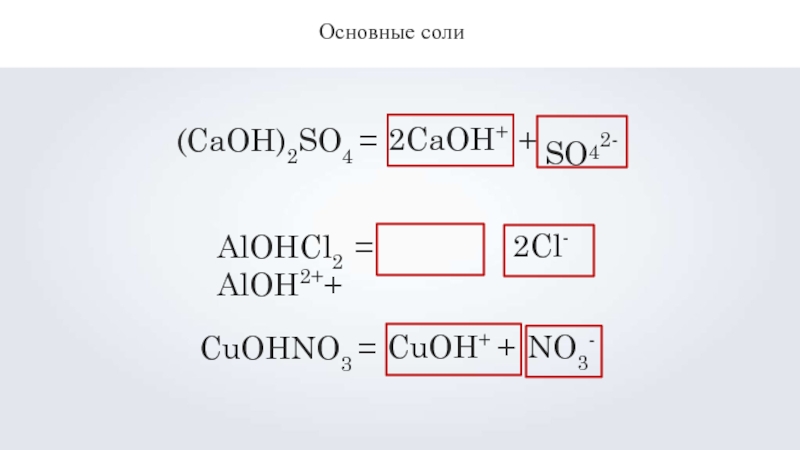
- 12. Основные соли(CaOH)2SO4 =2CaOH++ SO42-атомы металла+ гидроксогруппаанионы кислотного
- 13. Основные соли(CaOH)2SO4 =2CaOH++SO42-AlOHCl2 = AlOH2++2Cl-CuOHNO3 =CuOH+ +NO3-
- 14. Классификация солей и их электролитическая диссоциация основана
Слайд 2Соли – это класс химических соединений, состоящих из ионов металла и
Слайд 3Соли – электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+)
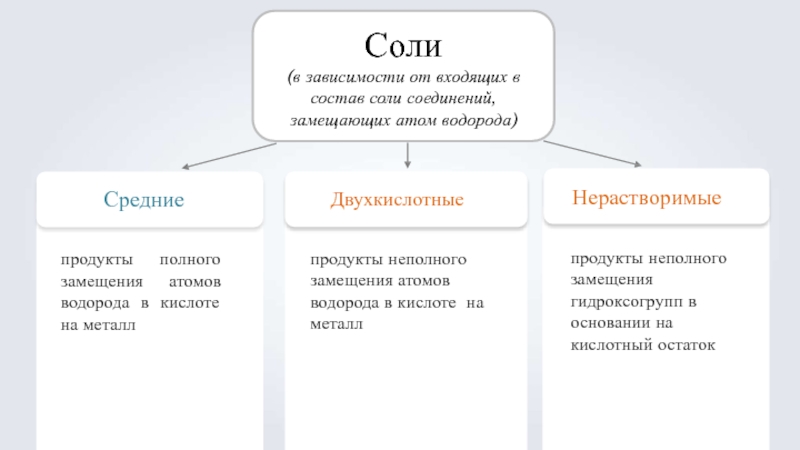
Слайд 4Соли
(в зависимости от входящих в состав соли соединений, замещающих атом водорода)
Средние
продукты
Двухкислотные
продукты неполного замещения атомов водорода в кислоте на металл
Нерастворимые
продукты неполного замещения гидроксогрупп в основании на кислотный остаток
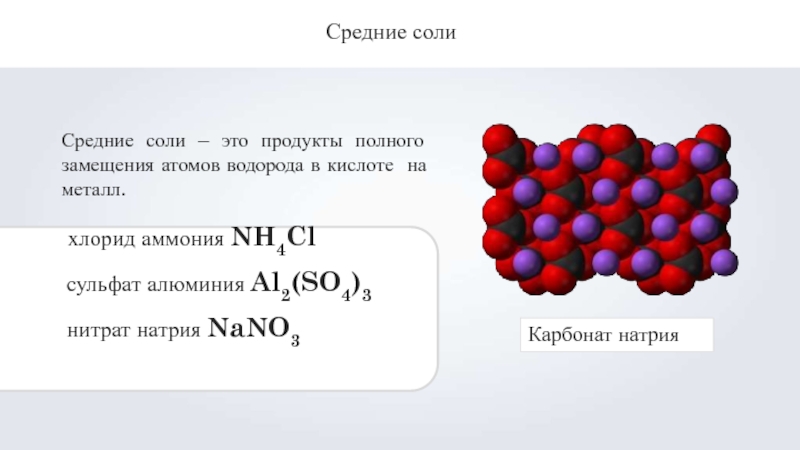
Слайд 5Средние соли
Средние соли – это продукты полного замещения атомов водорода в
Карбонат натрия
хлорид аммония NH4Cl сульфат алюминия Al2(SO4)3 нитрат натрия NaNO3
Слайд 6Средние соли
Al2(SO4)3 =
2Al3+
2-
+ 3SO4
анионы кислотного остатка
катионы
металла
Связь катионов металла с кислотным остатком
Слайд 8Кислые соли
Кислые соли – это продукты неполного замещения атомов водорода в
гидрофосфат калия
K2HPO4
гидро-
дигидро-
гидросульфат натрия NaHSO4 дигидрофосфат калия KH2PO4 гидрокарбонат кальция Ca(HCO3)2
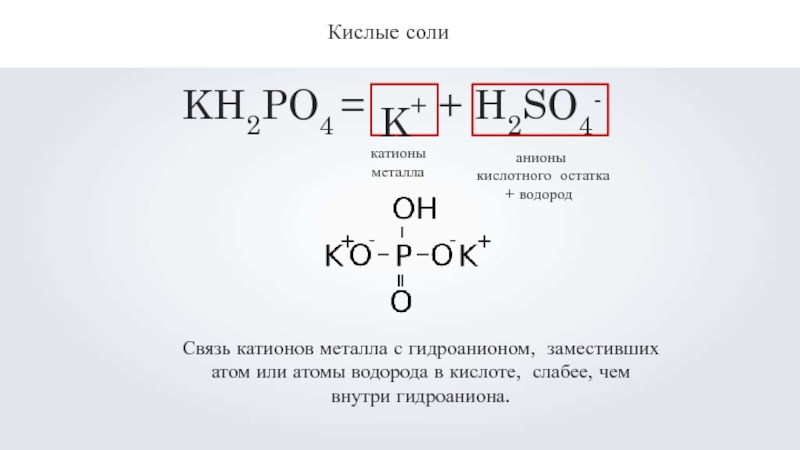
Слайд 9Кислые соли
KH2PO4 =
K+
+ H2SO4
-
катионы металла
анионы кислотного остатка + водород
Связь катионов металла с
Слайд 11Основные соли
Гидроксохлорид алюминия
Основные соли – это продукты неполного замещения гидроксогрупп в
гидроксосульфат цинка (ZnOH)2SO4
гидроксохлорид алюминия
AlOHCl2
гидроксонитрат меди
CuOHNO3