- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Серная кислота
Содержание
- 1. Презентация по химии Серная кислота
- 2. H2SO4 - серная кислота Получение H2SO4В
- 3. 2 стадияSO2 + O2↔2 SO3 (при повышенной
- 4. Физические свойства серной кислотыБесцветнаяТяжелая (ρ=1,84 г/см3 )ЖидкостьПри растворении в воде выделяется большое количество теплотыОбладает высокой гигроскопичностью
- 5. Химические свойства концентрированной серной кислотыСерная кислота –
- 6. Концентрированная серная кислота отщепляет от органических соединений
- 7. Химические свойства разбавленной серной кислотыВзаимодействует с металлами,
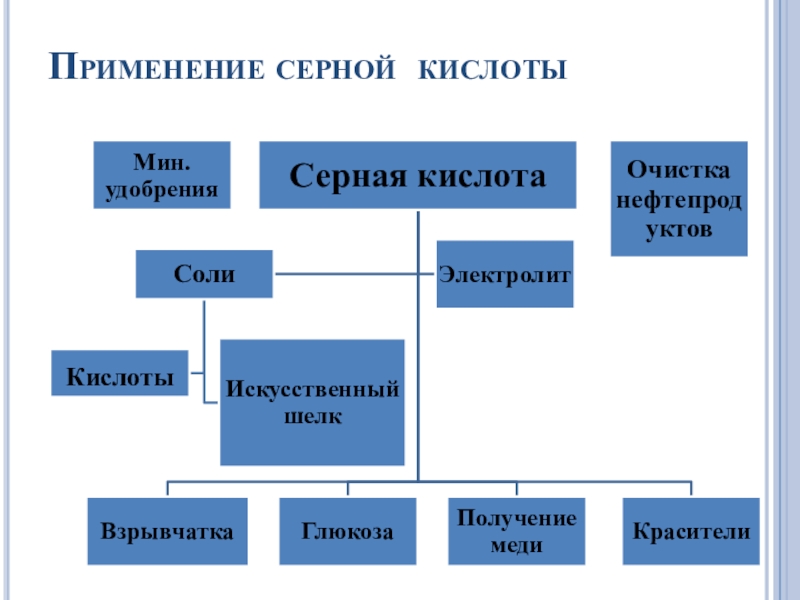
- 8. Применение серной кислоты
H2SO4 - серная кислота Получение H2SO4В природе данная кислота не встречаетсяВ промышленности H2SO4 получают из серы или пирита FeS2 контактным способом в три стадии: 1 стадия4FeS2 + 11O2→2Fe2O3+ 8SO2 или S + O2→SO2
Слайд 2H2SO4 - серная кислота
Получение H2SO4
В природе данная кислота не встречается
В
промышленности H2SO4 получают из серы или пирита FeS2 контактным способом в три стадии:
1 стадия
4FeS2 + 11O2→2Fe2O3+ 8SO2 или
S + O2→SO2
1 стадия
4FeS2 + 11O2→2Fe2O3+ 8SO2 или
S + O2→SO2
Слайд 32 стадия
SO2 + O2↔2 SO3 (при повышенной температуре и катализаторе V2O5
3 стадия
SO3+ H2O = H2SO4 + Q
SO3+ H2O = H2SO4 + Q
Слайд 4Физические свойства серной кислоты
Бесцветная
Тяжелая (ρ=1,84 г/см3 )
Жидкость
При растворении в воде выделяется
большое количество теплоты
Обладает высокой гигроскопичностью
Обладает высокой гигроскопичностью
Слайд 5Химические свойства концентрированной серной кислоты
Серная кислота – кислота –окислитель, за счет
серы в высшей степени окисления +6.
Реагирует со всеми металлами, кроме: Al, Cr, Au, Pt - реакция пассивации ( на холоде)
В зависимости от активности металла выделяются: SO2, H2S, S
Zn + 2H2SO4(конц) = ZnSO4+ SO2↑+ 2H2O
2Ag + 2H2SO4(конц) = Ag2SO4+ SO2↑+ 2H2O
Реагирует со всеми металлами, кроме: Al, Cr, Au, Pt - реакция пассивации ( на холоде)
В зависимости от активности металла выделяются: SO2, H2S, S
Zn + 2H2SO4(конц) = ZnSO4+ SO2↑+ 2H2O
2Ag + 2H2SO4(конц) = Ag2SO4+ SO2↑+ 2H2O
Слайд 6Концентрированная серная кислота отщепляет от органических соединений воду, обугливая их
Реагирует с
некоторыми неметаллами
C +2H2SO4(конц) = CO2↑+ SO2↑+ 2H2O
S +2H2SO4(конц) =3 SO2↑+ 2H2O
Концентрированная кислота энергично реагирует с водой с образованием гидратов
H2SO4(конц) + n H2O→ H2SO4*n H2O + Q
C +2H2SO4(конц) = CO2↑+ SO2↑+ 2H2O
S +2H2SO4(конц) =3 SO2↑+ 2H2O
Концентрированная кислота энергично реагирует с водой с образованием гидратов
H2SO4(конц) + n H2O→ H2SO4*n H2O + Q
Слайд 7Химические свойства разбавленной серной кислоты
Взаимодействует с металлами, стоящими левее водорода
Zn +
H2SO4(разб) = ZnSO4+ H2↑
Взаимодействует с основными и амфотерными оксидами
MgO + H2SO4→MgSO4+ H2O
Взаимодействует с основаниями
Mg(OH)2 + H2SO4→MgSO4+ 2H2O
Если кислота в избытке , то образуется кислая соль
Mg(OH)2 + 2H2SO4 (изб)→Mg(HSO4)2+ 2H2O
Взаимодействует с основными и амфотерными оксидами
MgO + H2SO4→MgSO4+ H2O
Взаимодействует с основаниями
Mg(OH)2 + H2SO4→MgSO4+ 2H2O
Если кислота в избытке , то образуется кислая соль
Mg(OH)2 + 2H2SO4 (изб)→Mg(HSO4)2+ 2H2O