- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Серная кислота
Содержание
- 1. Презентация по химии Серная кислота
- 2. Слайд 2
- 3. Тема урока: «Серная кислота и
- 4. Цель урока:Изучить свойства серной кислоты и выявить
- 5. «Лучший путь к истине – это изучать
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Физические свойства серной кислоты.Безводная серная кислота -
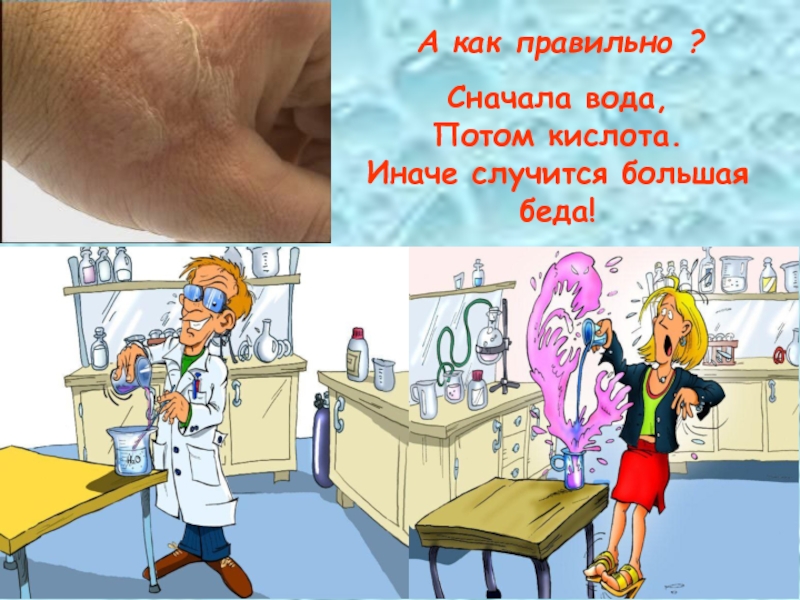
- 10. А как правильно ?Сначала вода, Потом кислота. Иначе случится большая беда!
- 11. Правила техники безопасности обращения с H2SO41. Обращаться
- 12. Группа хранения
- 13. Всегда держись на чеку!Козьма Прутков
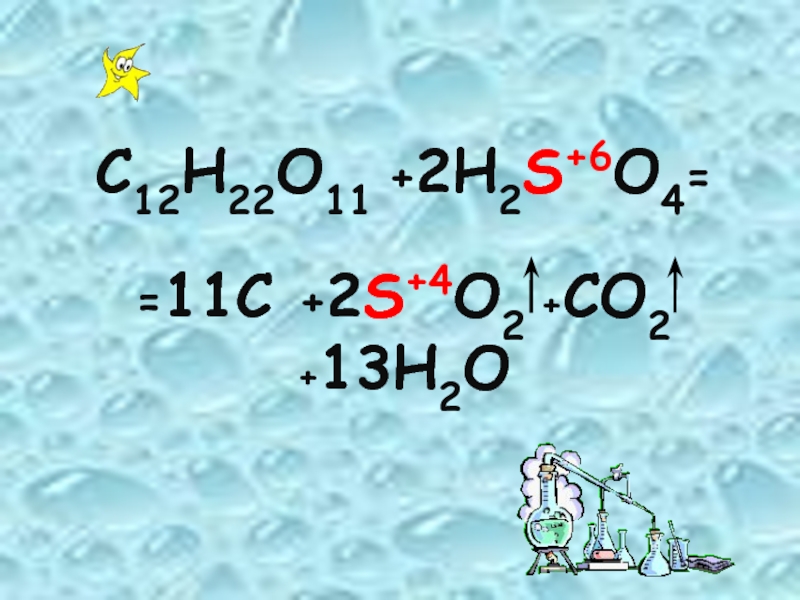
- 14. C12H22O11 +2H2S+6O4= =11C +2S+4O2 +CO2 +13H2O
- 15. Химические свойства разбавленной серной кислотыH2SO4с металлами до
- 16. Выберите, с какими из перечисленных
- 17. Раствор серной кислоты взаимодействует с металлами
- 18. Раствор серной кислоты взаимодействует с основными
- 19. Серная кислота взаимодействует с основаниями.2NaOН + H2SO4
- 20. Серная кислота взаимодействует с солями, если образуется
- 21. Слайд 21
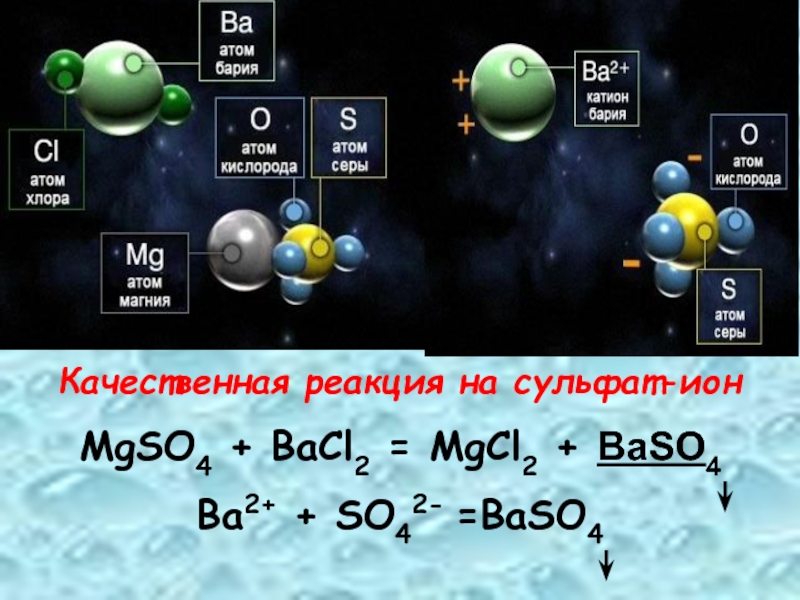
- 22. Качественная реакция на сульфат-ионMgSO4 + BaCl2 = MgCl2 + BaSO4Ba2+ + SO42- =BaSO4
- 23. Опыт - единственно верный путь спрашивать природу и слышать ответ в её лаборатории. Д.И. Менделеев
- 24. Экспериментальная задача Под номерами даны растворы
- 25. №1№3№2№4BaCl2AgNO3м/о№1 и №4 сульфаты№2 и №3 галогениды№1№4№2№3№1
- 26. №2№1№3№4BaCl2AgNO3метилоранжBaSO4белый осадокBaSO4белый осадокAgClбелый творожистый осадокAgIжелтый осадокоранжевыйрозовыйпроверкапроверкапроверка
- 27. Взаимодействие концентрированной серной кислоты с металлами.Me +
- 28. Составьте уравнение реакции магния с концентрированной серной
- 29. Взаимодействие концентрированной серной кислоты с металлами.Me +
- 30. C+Н2SO4 = CO2 + SO2 + H2OРасставьте коэффициенты методом электронного баланса.Взаимодействие концентрированной серной кислоты с неметаллами
- 31. Вулкан Малый Семячик Вулканический хребет длиной около 3
- 32. Слайд 32
- 33. Задание На заводе долгое время
- 34. В руки учителя на экзамене
- 35. Домашнее задание:Составьте молекулярные, полные и сокращённые ионные уравнения для экспериментальной задачи.
- 36. РефлексияМне грустно, я не всё понял Мне
- 37. Желаю успехов в учебе
Слайд 1
Уважаемые гости!!!
Вас приветствуют учащиеся
9 класса
и учитель химии Баймашкина Татьяна Александровна
Слайд 3 Тема урока:
«Серная кислота и её свойства»
Я растворю любой металл.
Меня алхимик получал
В реторте глиняной простой. Слыву я главной кислотой...
Когда сама я растворяюсь
В воде,
то сильно нагреваюсь.
Слайд 4Цель урока:
Изучить свойства серной кислоты и выявить характерные свойства этого вещества,
Слайд 5
«Лучший путь к истине – это изучать вещи, как они есть,
Д.Локк
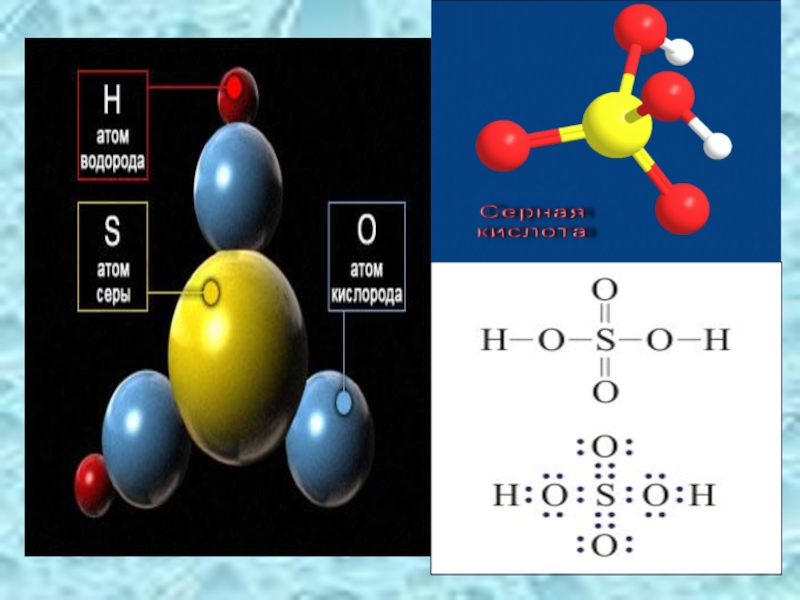
Слайд 9Физические свойства серной кислоты.
Безводная серная кислота - это бесцветная маслянистая жидкость
смешивается с водой в любых отношениях,
t пл. =10,30 С, t кип = 2960С,
=1, 84 г/см3.
Обладает сильным водоотнимающим действием.
Слайд 11Правила техники безопасности обращения с H2SO4
1. Обращаться осторожно!
3. Берегись ожога! Во избежания выбрызгивания и ожогов кислоту при сливании лить тонкой струей в воду, а не наоборот!
4. При попадании кислоты на кожу её сразу следует смыть большим количеством проточной воды, а пострадавшее место затем аккуратно смочить « нашатырным спиртом» или раствором питьевой соды и вновь смыть водой.
Слайд 15Химические свойства разбавленной серной кислоты
H2SO4
с металлами до Н2
( СОЛЬ +
с солями
(соль+кислота), если образуется газ или осадок
с основаниями
( соль + вода)
с оксидами металлов
(соль + вода)
Слайд 16
Выберите, с какими из перечисленных веществ реагирует разбавленная серная
серебро,цинк,
оксид меди(II),
гидроксид натрия,
хлорид бария.
Составьте уравнения возможных реакций.
Слайд 17 Раствор серной кислоты взаимодействует с металлами , стоящими в ряду
Ag + H2SO4 = т.к. серебро стоит в ряду активности после водорода
Zn + H2SO4 = ZnSO4 +H2
Zn0 + 2H+ = Zn 2+ +H20
Слайд 18 Раствор серной кислоты взаимодействует с основными и амфотерными оксидами.
CuO
CuO + 2H+ = Cu2+ + H2O
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
Слайд 19Серная кислота взаимодействует с основаниями.
2NaOН + H2SO4 = Na2SO4 + 2H2O
H+ + ОН- = H2O
NaOН + H2SO4 = NaНSO4 + Н2O
гидросульфат калия
2H+ + OН- + SO42- = НSO4- + H2O
Слайд 20Серная кислота взаимодействует с солями, если образуется газ или осадок.
BaCl2 +
Ba2+ + SO42- = BaSO4
Слайд 23Опыт - единственно верный путь спрашивать природу и слышать ответ в
Д.И. Менделеев
Слайд 24
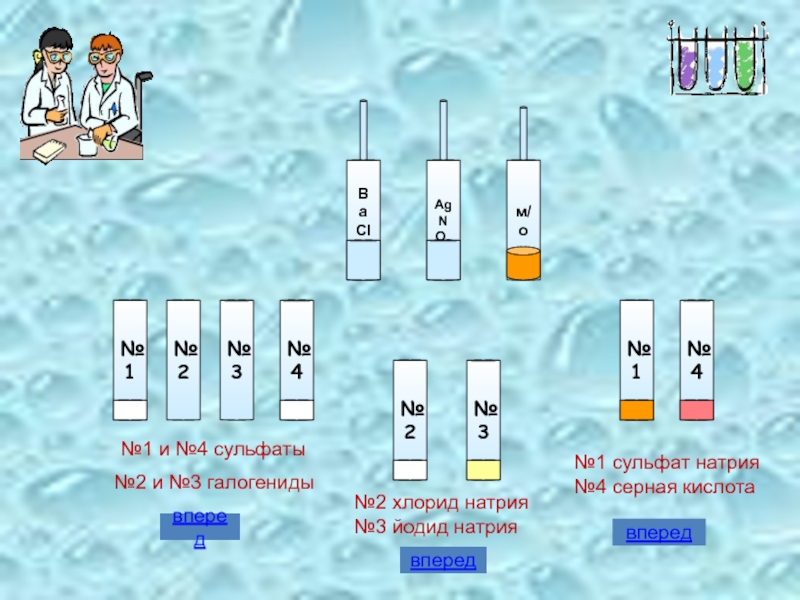
Экспериментальная задача
Под номерами даны растворы хлорида натрия, сульфата натрия,
Слайд 25
№1
№3
№2
№4
BaCl2
AgNO3
м/о
№1 и №4 сульфаты
№2 и №3 галогениды
№1
№4
№2
№3
№1 сульфат натрия №4 серная
№2 хлорид натрия №3 йодид натрия
вперед
вперед
вперед
Слайд 26
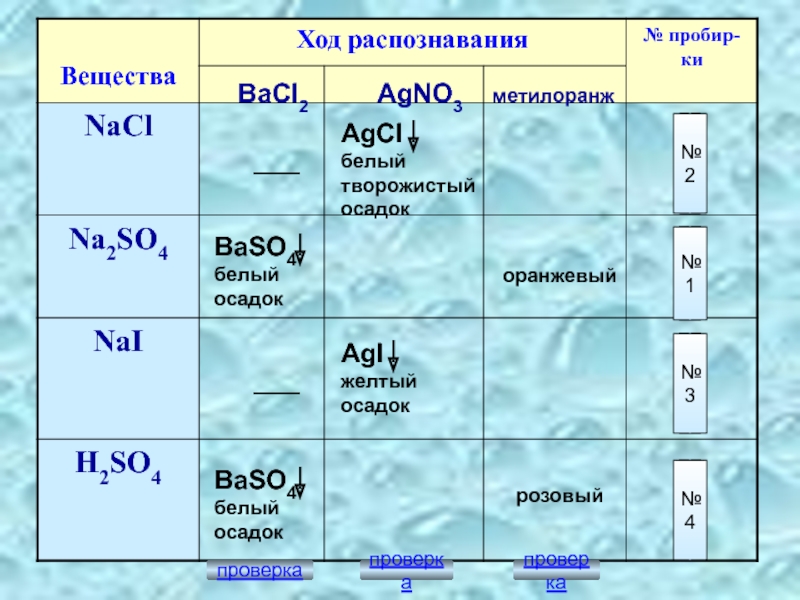
№2
№1
№3
№4
BaCl2
AgNO3
метилоранж
BaSO4
белый осадок
BaSO4
белый осадок
AgCl
белый творожистый осадок
AgI
желтый осадок
оранжевый
розовый
проверка
проверка
проверка
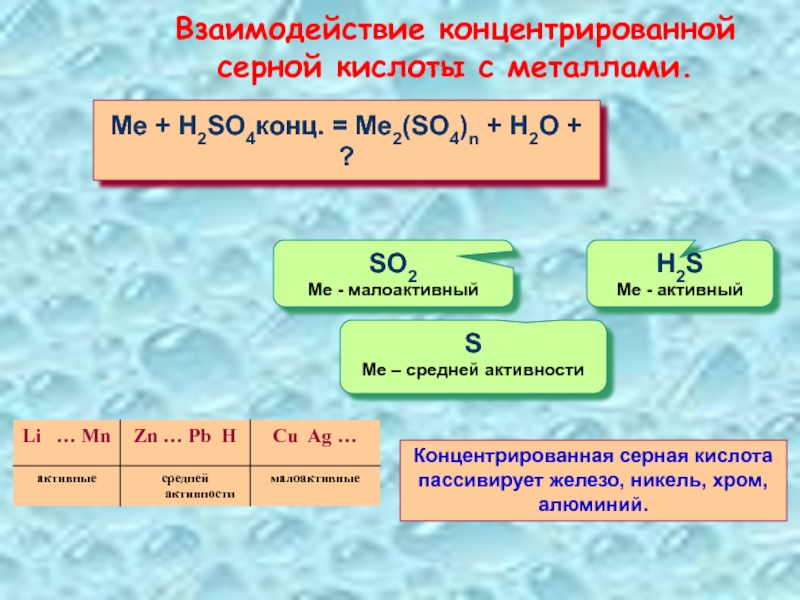
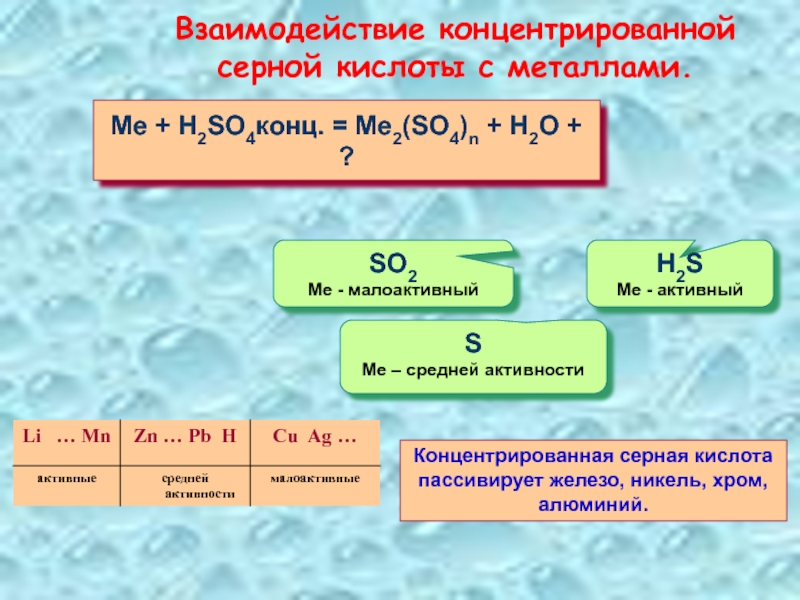
Слайд 27Взаимодействие концентрированной серной кислоты с металлами.
Me + H2SO4конц. = Me2(SO4)n +
S
Ме – средней активности
H2S
Ме - активный
SO2
Ме - малоактивный
Концентрированная серная кислота пассивирует железо, никель, хром, алюминий.
Слайд 28Составьте уравнение реакции магния с концентрированной серной кислотой, используя метод электронного
Mg + H2SO4 = MgSO4 + H2S + H2O
= S-2
+6
-2
+2
4
1
процесс окисления
процесс восстановления
окислитель
восстановитель
0
Mg0
-2 e
= Mg+2
S+6
+ 8e
4
5
5х2-2=
8
4
Слайд 29Взаимодействие концентрированной серной кислоты с металлами.
Me + H2SO4конц. = Me2(SO4)n +
S
Ме – средней активности
H2S
Ме - активный
SO2
Ме - малоактивный
Концентрированная серная кислота пассивирует железо, никель, хром, алюминий.
Слайд 30C+Н2SO4 =
CO2 + SO2 + H2O
Расставьте коэффициенты методом электронного баланса.
Взаимодействие
Слайд 31Вулкан Малый Семячик
Вулканический хребет длиной около 3 км., на гребне которого
Кислотные озера
Слайд 33Задание
На заводе долгое время перекачивали серную кислоту из
Слайд 34 В руки учителя на экзамене попала шпаргалка ученика, он
Слайд 35Домашнее задание:
Составьте молекулярные, полные и сокращённые ионные уравнения для экспериментальной задачи.
Слайд 36Рефлексия
Мне грустно, я не всё понял
Мне обидно, что не спросили
Я
Мне понравилось
Я в восторге, всё понял
Я удивлён