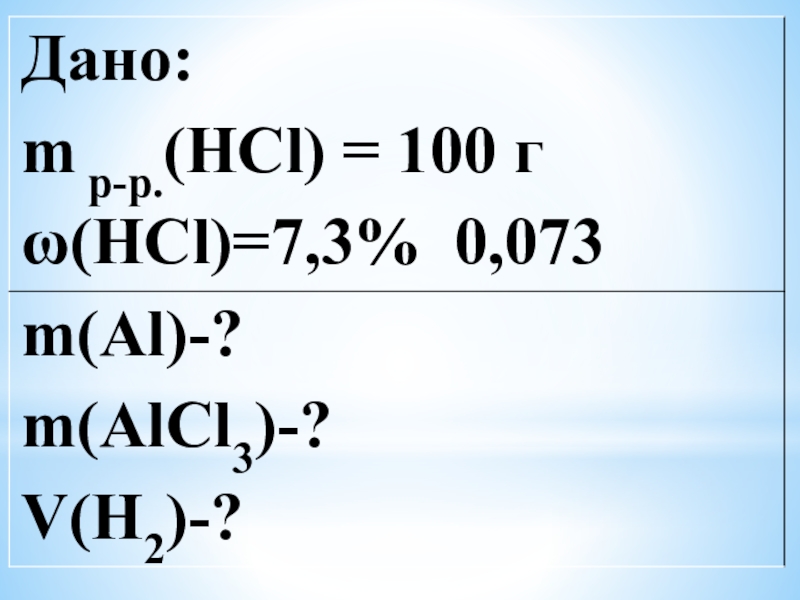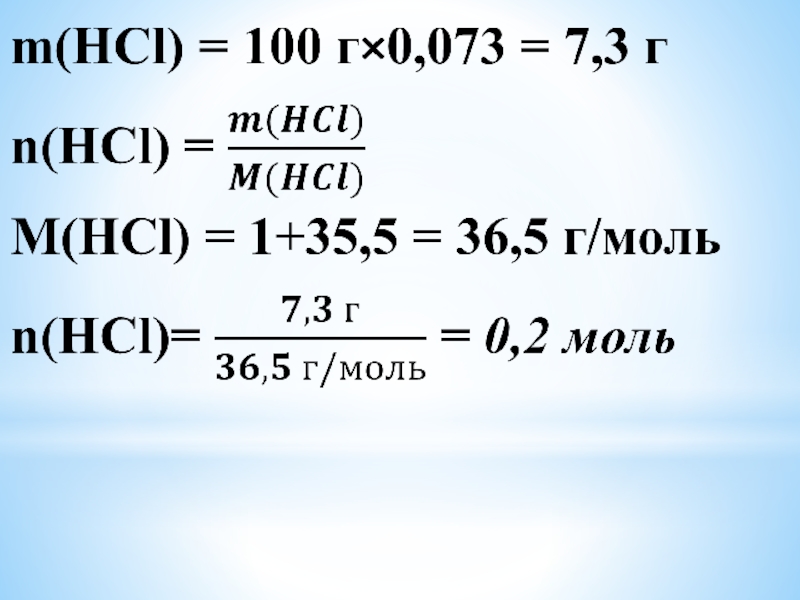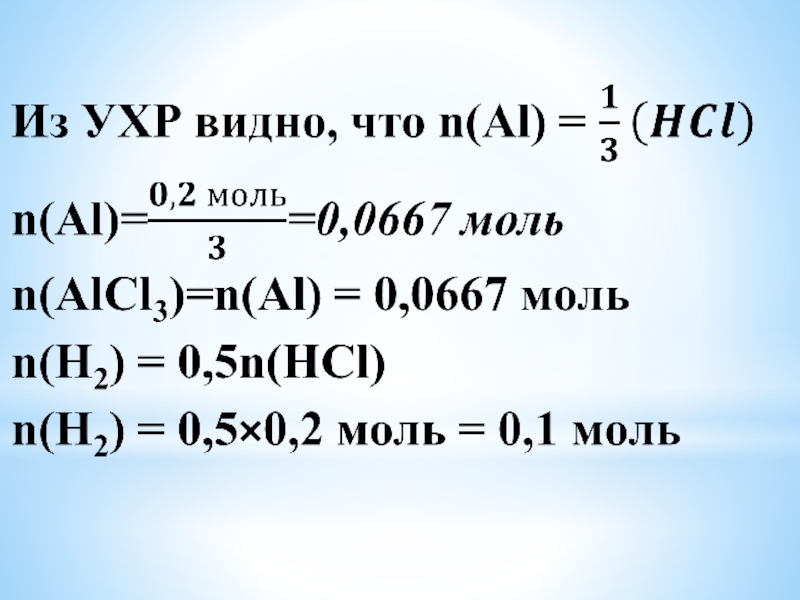- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Решение тренировочных упражнений. 8 класс
Содержание
- 1. Презентация по химии Решение тренировочных упражнений. 8 класс
- 2. Закрепить знания по массовой доле растворенного вещества,
- 3. Проверка домашнегозадания
- 4. Найти массу алюминия, вступившей в реакцию со
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. 2) Составляем УХР, подчеркиваем одной линией то,
- 9. Слайд 9
- 10. 3) Находим молярные массы хлорида алюминия и
- 11. Ответ: 1,8 г; 8,9 г; 2,24 л
- 12. Задание в классе
- 13. Какая масса осадка образуется при взаимодействии 104
- 14. Домашнее заданиеПовторить §§ 40,41,42,45,47,16,19,34, 25 Закончить решение упражнений
Закрепить знания по массовой доле растворенного вещества, алгоритму решения задач с использованием массовой доли ω, с составлением уравнений химических реакций, расчетами по химическим реакциям; подготовка к итоговой контрольной работе.
Слайд 2Закрепить знания по массовой доле растворенного вещества, алгоритму решения задач с
использованием массовой доли ω, с составлением уравнений химических реакций, расчетами по химическим реакциям; подготовка к итоговой контрольной работе.
Слайд 4Найти массу алюминия, вступившей в реакцию со 100 г 7,3% раствором
соляной кислоты, массу образовавшей-ся соли и объем газа, который при этом выделился.
Слайд 82) Составляем УХР, подчеркиваем одной линией то, что дано и двумя
те вещества, которые необходимо найти:
2Al + 6HCl = 2AlCl3 + 3H2↑
Стереометрические коэффициен-ты показывают количество каж-дого вещества в УХР
2Al + 6HCl = 2AlCl3 + 3H2↑
Стереометрические коэффициен-ты показывают количество каж-дого вещества в УХР
Слайд 103) Находим молярные массы хлорида алюминия и алюминия и вычисляем их
массы; вычисляем объем выделившегося газа – водорода.
M(AlCl3) = 27+3×35,5 = 133,5 г/моль
M(Al) = 27 г/моль
Vm = 22,4 л/моль
m(Al) = n(Al)×M(Al) = 0,0667 моль×27 г/моль =
= 1,8 г
m(AlCl3)=n(AlCl3)×M(AlCl3) =
= 0,0667 моль × 133,5 г/моль = 8,9 г
V(H2)= n(H2)×Vm = 0,1 моль×22,4 л/моль = 2,24 л
M(AlCl3) = 27+3×35,5 = 133,5 г/моль
M(Al) = 27 г/моль
Vm = 22,4 л/моль
m(Al) = n(Al)×M(Al) = 0,0667 моль×27 г/моль =
= 1,8 г
m(AlCl3)=n(AlCl3)×M(AlCl3) =
= 0,0667 моль × 133,5 г/моль = 8,9 г
V(H2)= n(H2)×Vm = 0,1 моль×22,4 л/моль = 2,24 л
Слайд 13Какая масса осадка образуется при взаимодействии 104 г 25% раствора хлорида
бария с раствором сульфата железа (II)?
Какую массу воды необходимо добавить к 100 г 25% раствора хлорида натрия, чтобы получить 5% раствор?
Закончите схемы практически осуществимых реакций:
NaOH + KOH →
MgCl2 + AgNO3 →
Mg + H2SO4 →
Cu(OH)2 + HNO3 →
KClO3 → t
Назовите тип химической реакции.
Какую массу воды необходимо добавить к 100 г 25% раствора хлорида натрия, чтобы получить 5% раствор?
Закончите схемы практически осуществимых реакций:
NaOH + KOH →
MgCl2 + AgNO3 →
Mg + H2SO4 →
Cu(OH)2 + HNO3 →
KClO3 → t
Назовите тип химической реакции.