цена!
И знаю, все твои пути
К успеху могут привести!
(С.Щипачёв)
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Реакции обмена
Содержание
- 1. Презентация по химии Реакции обмена
- 2. Пройди тестВариант I.Расставьте коэффициенты в приведенных схемах.
- 3. Проверь соседа.Вариант I.Fe2O3 + 2Al → Al2O3
- 4. 2 балла и менее - «2» 2,5
- 5. Определите тип реакции3CuO + 2Al → 3Cu
- 6. Реакции обменаЦель урока: Развитие знаний учащихся о химических реакциях при формировании представлений о реакции обмена.
- 7. Реакции обмена - это реакции, протекающие между
- 8. Щелочь + кислота = вода +сольРеакция нейтрализации - это реакция между щелочью и кислотой.
- 9. Слайд 9
- 10. Все ли реакции, протекающие в растворах между
- 11. Слайд 11
- 12. Игра «Что лишнее?» 1.
- 13. РаздражениеЗлостьРадостьРавнодушие.УдовлетворениеВдохновениеСкука.Тревога.Покой.УверенностьНеуверенность.НаслаждениеВыберите одно слово, характеризующее ваше состояние после урока.
- 14. Домашнее задание§33, № 3 (а), № 4(в,г,д), №6(задача).Спасибо за урок!!!
Пройди тестВариант I.Расставьте коэффициенты в приведенных схемах. Укажите тип химической реакции.Fe2O3 + Al → Al2O3 + Fe Fe(OH)3 → Fe2O3 + H2O KHCO3 → K2CO3 + H2O + CO2Al + H2SO4 → Al2(SO4)3 +H2Mg + N2
Слайд 2Пройди тест
Вариант I.
Расставьте коэффициенты в приведенных схемах. Укажите тип химической реакции.
Fe2O3
+ Al → Al2O3 + Fe
Fe(OH)3 → Fe2O3 + H2O
KHCO3 → K2CO3 + H2O + CO2
Al + H2SO4 → Al2(SO4)3 +H2
Mg + N2 → Mg3N2
Вариант II.
Расставьте коэффициенты в приведенных схемах. Укажите тип химической реакции.
Fe + Cl2 → FeCl3
KClO3 → KCl + O2
N2O5 + H2O → HNO3
Fe2O3 + Mg → MgO + Fe
H2O + P2O5 → H3PO4
Fe(OH)3 → Fe2O3 + H2O
KHCO3 → K2CO3 + H2O + CO2
Al + H2SO4 → Al2(SO4)3 +H2
Mg + N2 → Mg3N2
Вариант II.
Расставьте коэффициенты в приведенных схемах. Укажите тип химической реакции.
Fe + Cl2 → FeCl3
KClO3 → KCl + O2
N2O5 + H2O → HNO3
Fe2O3 + Mg → MgO + Fe
H2O + P2O5 → H3PO4
Слайд 3Проверь соседа.
Вариант I.
Fe2O3 + 2Al → Al2O3 +2Fe
замещение
2Fe(OH)3 → Fe2O3
+ 3H2O
разложение
2KHCO3 →K2CO3+H2O +CO2
разложение
2Al +3H2SO4 →Al2(SO4)3 +3H2
замещение
3Mg + N2 → Mg3N2
соединение
Вариант II.
2Fe +3Cl2 → 2FeCl3
соединение
2KClO3 →2KCl +3O2
разложение
N2O5 + H2O →2HNO3
соединение
Fe2O3 +3Mg →3MgO +2Fe
замещение
3H2O + P2O5 → 2H3PO4
соединение
разложение
2KHCO3 →K2CO3+H2O +CO2
разложение
2Al +3H2SO4 →Al2(SO4)3 +3H2
замещение
3Mg + N2 → Mg3N2
соединение
Вариант II.
2Fe +3Cl2 → 2FeCl3
соединение
2KClO3 →2KCl +3O2
разложение
N2O5 + H2O →2HNO3
соединение
Fe2O3 +3Mg →3MgO +2Fe
замещение
3H2O + P2O5 → 2H3PO4
соединение
Правильно расставлены коэффициенты 0,5 балла за каждое уравнение, определен верно тип реакции 0,5 балла за каждую реакцию. Максимальное количество баллов «5»
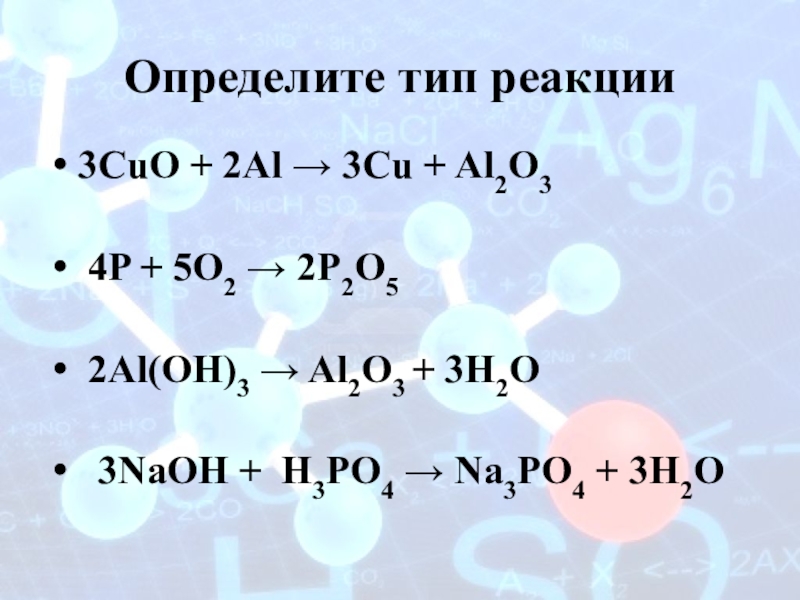
Слайд 5Определите тип реакции
3CuO + 2Al → 3Cu + Al2O3
4P +
5O2 → 2P2O5
2Al(OH)3 → Al2O3 + 3H2O
3NаОН + H3PO4 → Na3PO4 + 3H2O
2Al(OH)3 → Al2O3 + 3H2O
3NаОН + H3PO4 → Na3PO4 + 3H2O
Слайд 6Реакции обмена
Цель урока: Развитие знаний учащихся о химических реакциях при формировании
представлений о реакции обмена.
Слайд 7Реакции обмена - это реакции, протекающие между двумя сложными веществами, в
результате чего они обмениваются своими составными частями.
Слайд 10Все ли реакции, протекающие в растворах между двумя сложными веществами, будут
протекать до конца?
NaOH + KCl
≠ NaCl + KOH
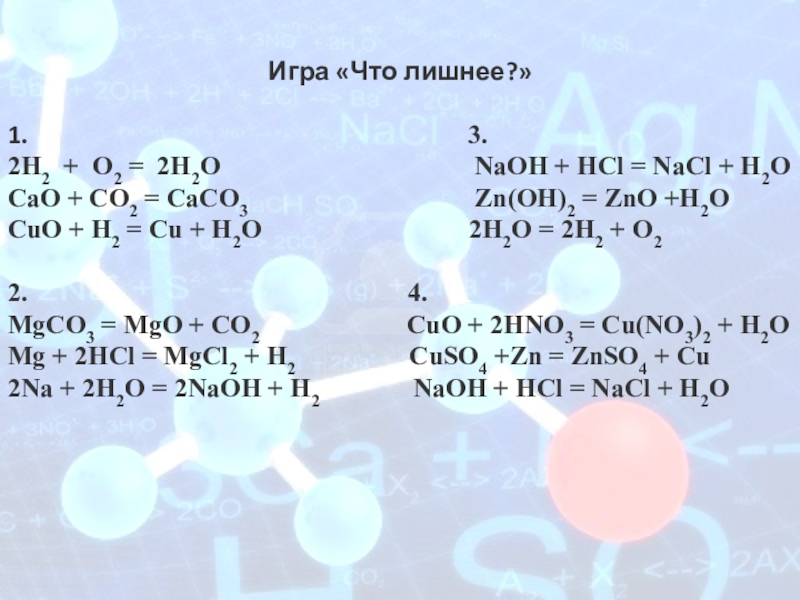
Слайд 12Игра «Что лишнее?»
1.
3.
2Н2 + О2 = 2Н2О NaOH + HCl = NaCl + H2O СаО + СО2 = СаСО3 Zn(OH)2 = ZnO +H2O СuО + Н2 = Cu + Н2О 2H2O = 2H2 + O2
2. 4.
MgCO3 = MgO + CO2 CuO + 2HNO3 = Cu(NO3)2 + H2O Mg + 2HCl = MgCl2 + H2 CuSO4 +Zn = ZnSO4 + Cu 2Na + 2H2O = 2NaOH + H2 NaOH + HCl = NaCl + H2O
2Н2 + О2 = 2Н2О NaOH + HCl = NaCl + H2O СаО + СО2 = СаСО3 Zn(OH)2 = ZnO +H2O СuО + Н2 = Cu + Н2О 2H2O = 2H2 + O2
2. 4.
MgCO3 = MgO + CO2 CuO + 2HNO3 = Cu(NO3)2 + H2O Mg + 2HCl = MgCl2 + H2 CuSO4 +Zn = ZnSO4 + Cu 2Na + 2H2O = 2NaOH + H2 NaOH + HCl = NaCl + H2O