- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Реакции ионного обмена
Содержание
- 1. Презентация по химии Реакции ионного обмена
- 2. Реакции между ионами называют
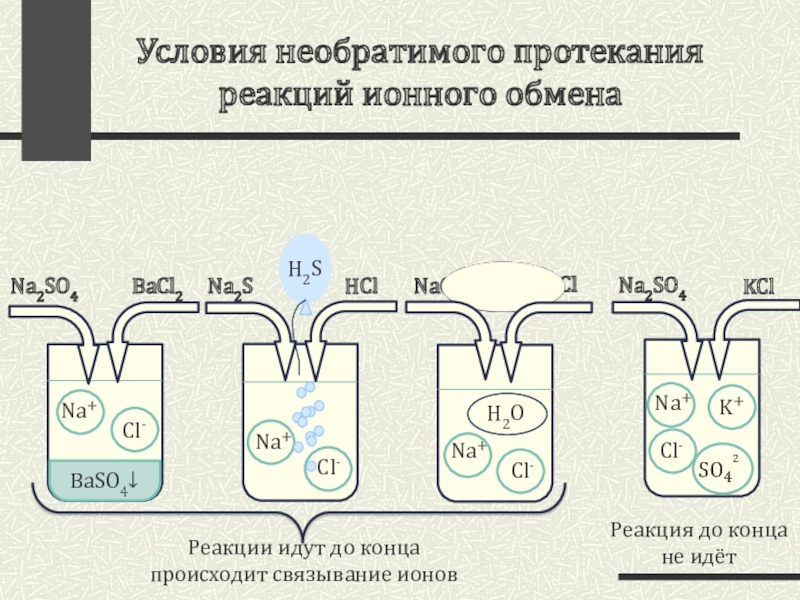
- 3. Условия необратимого протекания реакций ионного обменаNa2SO4KClNa2SO4BaCl2Реакция до конца не идёт Na2SHClNaOHHClH2OРеакции идут до концапроисходит связывание ионов
- 4. Правила составления ионных уравнений
- 5. Правила составления ионных уравнений
- 6. Правила составления ионных уравнений
- 7. Правила составления ионных уравнений
- 8. Примеры реакций ионного обмена Молекулярное
- 9. Примеры реакций ионного обмена Молекулярное
- 10. Примеры реакций ионного обмена Молекулярное
- 11. Примеры реакций ионного обмена Молекулярное
- 12. Примеры реакций ионного обмена Молекулярное
- 13. Примеры реакций ионного обмена
- 14. Примеры реакций ионного обмена Молекулярное
- 15. Примеры реакций ионного обмена
- 16. Примеры реакций ионного обмена
- 17. Примеры реакций ионного обмена
- 18. ИсточникиО. В. Мешкова. Интенсивная подготовка ЕГЭ. Химия. Универсальный справочник, М. Эксмо 2010 http://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8_%D0%B8%D0%BE%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE_%D0%BE%D0%B1%D0%BC%D0%B5%D0%BD%D0%B0http://him.1september.ru/2003/02/13.htm
Слайд 1Реакции ионного обмена
Карташова Людмила Александровна
учитель химии МАОУ «СОШ №27
с углубленным изучением
г. Балаково Саратовской области
Слайд 2 Реакции между ионами называют ионными реакциями, а уравнения
Большинство химических реакций протекают в растворах. Растворы электролитов содержат ионы, поэтому такие реакции сводятся к реакциям между ионами.
Реакций ионного обмена
Эти реакции по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например , H2O)
Слайд 3Условия необратимого протекания реакций ионного обмена
Na2SO4
KCl
Na2SO4
BaCl2
Реакция до конца
не идёт
Na2S
HCl
NaOH
HCl
H2O
Реакции
происходит связывание ионов
Слайд 4Правила составления ионных
уравнений
При составлении ионных уравнений
Слайд 5Правила составления ионных
уравнений
Сокращённое ионное уравнение –
Ba2+ + SO42- = BaSO4 ↓
Ba(NO3)2 K2SO4
BaCl2 H2SO4
Слайд 7Правила составления ионных
уравнений
Пример: Взаимодействие сульфата натрия
Запишем уравнение в молекулярном виде:
Na2SO4 + BaCl2 = BaSO4 + NaCl
2. Расставим коэффициенты
2
3. По таблице растворимости определим
нерастворимые вещества. Обозначим их стрелкой вниз.
↓
4. Составим полное ионное уравнение
6. Составим сокращённое ионное уравнение.
2Na+
2Cl-
BaSO4↓
+
Ba2+
+
+
+
=
2Na+
2Cl-
+
5. Сократим одинаковые ионы в левой и правой части
Полного ионного уравнения.
+
=
Ba2+
BaSO4↓
Слайд 8Примеры реакций ионного обмена
Молекулярное уравнение реакции щелочи с
КOH + HCl = KCl + H2O
Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O.
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O.
Слайд 9Примеры реакций ионного обмена
Молекулярное уравнение реакции основного оксида
CaO + 2HNO3 = Ca(NO3)2 + H2O.
Полное ионное уравнение реакции:
CaO+ 2H+ + 2NO-3 = Ca2+ + 2NO-3+ H2O
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O.
Слайд 10Примеры реакций ионного обмена
Молекулярное уравнение реакции нерастворимого основания
3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2 + 6H2O.
Полное ионное уравнение реакции:
3Mg(OH)2 + 6H++ 2PO43- = Mg3(PO4)2 + 6H2O
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
Слайд 11Примеры реакций ионного обмена
Молекулярное уравнение реакции амфотерного оксида
Al2O3 + 6HCl = 2AlCl3 + 3H2O.
Полное ионное уравнение реакции:
Al2O3 + 6H+ + 6Cl– = 2Al3+ + 6Cl– + 3H2O.
Cокращенное ионное уравнение реакции:
Al2O3 + 6H+ = 2Al3+ + 3H2O.
Слайд 12Примеры реакций ионного обмена
Молекулярное уравнение реакции растворимой соли
CuCl2 + 2KOH = 2KCl + Cu(OH)2 .
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2 .
Cокращенное ионное уравнение реакции:
Cu2+ + 2OH– = Cu(OH)2 .
Слайд 14Примеры реакций ионного обмена
Молекулярное уравнение реакции растворимой соли
K2S + 2HCl = 2KCl + H2S .
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S .
Cокращенное ионное уравнение реакции:
S2– + 2H+ = H2S .
Слайд 18Источники
О. В. Мешкова. Интенсивная подготовка ЕГЭ. Химия. Универсальный справочник, М. Эксмо
http://him.1september.ru/2003/02/13.htm