- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Реакции ионного обмена
Содержание
- 1. Презентация по химии Реакции ионного обмена
- 2. “Вода, у тебя нет ни
- 3. Ошибка* Убери лишнее. (Найдите неэлектролиты)О2NaOHОшибкаNaClОшибкаK2SO4CO2ОшибкаH2SO4CaCO3ОшибкаMg(NO3)2ОшибкаCuCl2BaSO4H2OCaSO4Cu(OH)2SО3ОшибкаFeCl3ОшибкаNaNO3ОшибкаK2SОшибкаCa(OH)2ОшибкаAl(NO3)3ОшибкаNa2CO3
- 4. Тема урока: Реакции ионного обмена.
- 5. Закончите уравнения реакций. Какие из предложенных реакций
- 6. *Тема: Реакции ионного обмена.I. РИО (реакции ионного
- 7. Условия необратимого протекания реакций ионного обмена:Если выделится
- 8. *Тема: Реакции ионного обмена.I. РИО (реакции ионного
- 9. *Тема: Условия протекания реакций ионного обмена.II. Если
- 10. Применение реакций ионного обменаРазрыхлители теста.Определение качества воды.Устранение
- 11. Правила «выживания» в химической лаборатории1.Выполнять только те
- 12. Лабораторная работа. Реакции ионного обмена. Вариант
- 13. Спасибо за работуВсе, что выучили вы пригодится,надо только никогда не лениться!
Слайд 2
“Вода, у тебя нет ни вкуса, ни цвета, ни
(А.С. Экзюпери)
Слайд 3Ошибка
*
Убери лишнее. (Найдите неэлектролиты)
О2
NaOH
Ошибка
NaCl
Ошибка
K2SO4
CO2
Ошибка
H2SO4
CaCO3
Ошибка
Mg(NO3)2
Ошибка
CuCl2
BaSO4
H2O
CaSO4
Cu(OH)2
SО3
Ошибка
FeCl3
Ошибка
NaNO3
Ошибка
K2S
Ошибка
Ca(OH)2
Ошибка
Al(NO3)3
Ошибка
Na2CO3
Слайд 5Закончите уравнения реакций. Какие из предложенных реакций относятся к реакциям обмена?
Слайд 6*
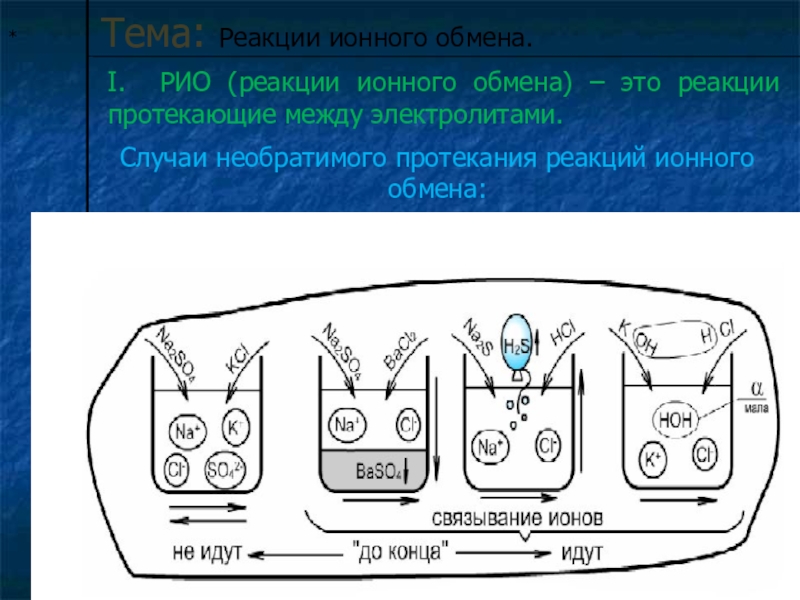
Тема: Реакции ионного обмена.
I. РИО (реакции ионного обмена) – это реакции
Случаи необратимого протекания реакций ионного обмена:
Слайд 7Условия необратимого протекания реакций ионного обмена:
Если выделится газ-
Это раз;
И получится
А еще - нерастворимый
Осаждается продукт…
"Есть осадок", - говорим мы.
Это третий важный пункт.
Химик "правила обмена"
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок –
Вот тогда порядок!
Слайд 8*
Тема: Реакции ионного обмена.
I. РИО (реакции ионного обмена) – это реакции
Пример: Взаимодействие хлорида бария с сульфатом натрия.
BaCl2 + Na2SO4 ? BaSO4 + NaCl
Ba2+
2Cl-
+
+
2Na+
SO42-
+
1. Записать уравнение реакции в молекулярном виде.
Порядок действий:
2. Расставить коэффициенты.
2
3. По таблице растворимости, определить нерастворимые вещества. Обозначить их стрелкой вниз.
4. Составить полное ионное уравнение (растворимые вещества расписать на ионы.
?
BaSO4
+
2Na+
+
2Cl-
5. Сократить одинаковые ионы в левой и правой части полного ионного уравнения.
6. Составить сокращенное ионное уравнение.
Ba2+
+
SO42-
?
BaSO4
Слайд 9*
Тема: Условия протекания реакций ионного обмена.
II. Если образуется газ.
Na2CO3 +
H2O
CO2
2Na+
CO32-
+
+
2H+
SO42-
+
?
2Na+
SO42-
+
+
+
CO32-
+
2H+
?
H2O
CO2
+
III. Если образуется вода.
2NaOH + H2SO4 ? Na2SO4 + 2H2O
2H2O
2Na+
2OH-
+
+
2H+
SO42-
+
?
2Na+
SO42-
+
+
2OH-
+
2H+
?
2H2O
OH-
+
H+
?
H2O
Слайд 10Применение реакций ионного обмена
Разрыхлители теста.
Определение качества воды.
Устранение жесткости воды.
Определение качества продуктов
Определение массовой доли уксусной кислоты в ее растворе.
Приготовление лекарственных растворов
Слайд 11Правила «выживания» в химической лаборатории
1.Выполнять только те опыты, которые указаны в
2.Использовать растворы в небольших количествах.
3.При работе с растворами кислот и щелочей соблюдать особую аккуратность и осторожность.