- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Производство серной кислоты
Содержание
- 1. Презентация по химии Производство серной кислоты
- 2. Цель работы:Выяснить какие научные принципы лежат в основе производства серной кислоты.
- 3. Сырьё и его подготовкаСырьё – природный
- 4. Химические реакции Подбор оптимальных условий производства
- 5. 1.Получение SO2. Обжиг пирита4 FeS2 + 11
- 6. 2. Окисление SO2
- 7. 3. Поглощение SO3 водойSO3 + H2O =
- 8. В ходе исследований мы выявили следующие научные
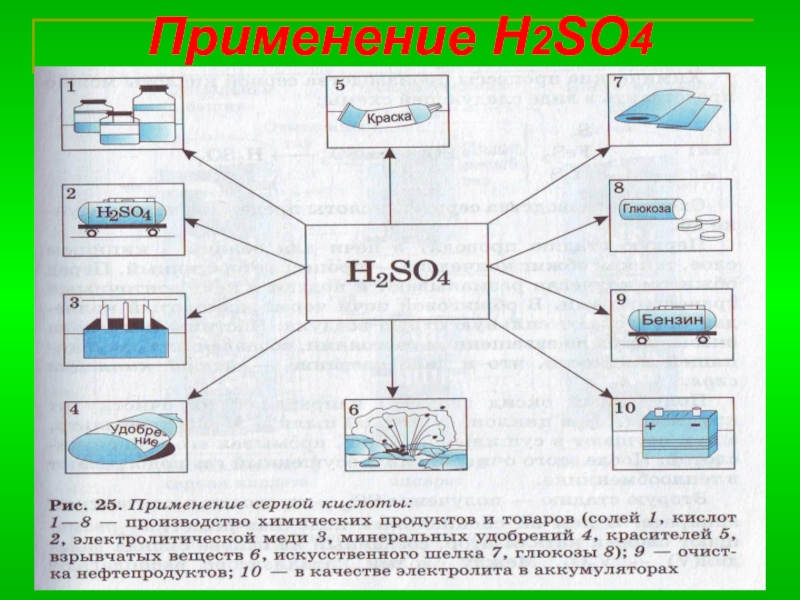
- 9. Применение H2SO4
- 10. Технологические процессы 1) Тепловые (нагревание смеси, охлаждение).2)
- 11. Экологические проблемы при производстве H2SO4Выбросы и отходы
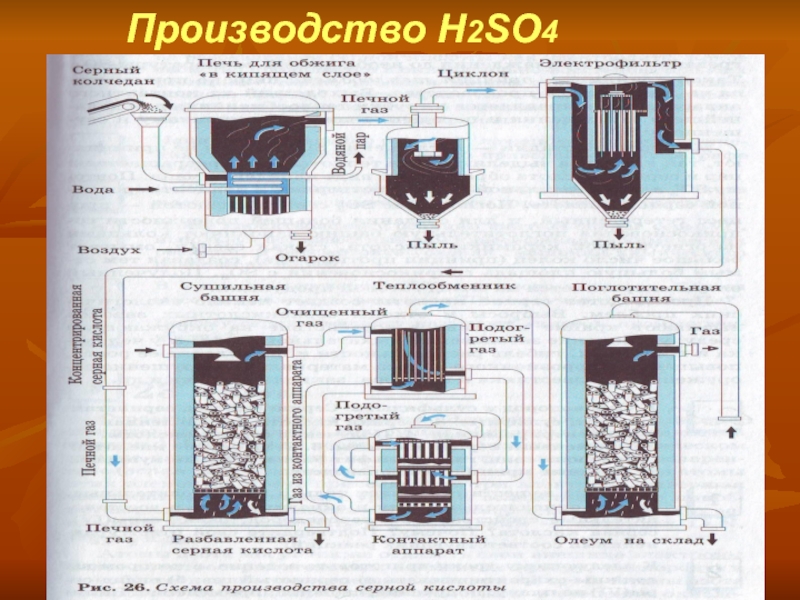
- 12. Производство H2SO4
Цель работы:Выяснить какие научные принципы лежат в основе производства серной кислоты.
Слайд 1Производство серной кислоты
Выполнили:
Ефремов Илья и Набиев Коля, учащиеся 9 класса
Руководитель:
Щенова Л.Н.
Слайд 3 Сырьё и его подготовка
Сырьё – природный материал, подвергающийся дальнейшей переработке.
Требования
к сырью: дешёвое и широко распространённое
Виды сырья в производстве серной кислоты:
Основное сырьё - самородная сера, руды цветных металлов(CuS, ZnS, PbS), FeS2-пирит, H2S ;
Дополнительное сырьё – воздух (кислород), катализатор( V2O5), 98% H2SO4.
Виды сырья в производстве серной кислоты:
Основное сырьё - самородная сера, руды цветных металлов(CuS, ZnS, PbS), FeS2-пирит, H2S ;
Дополнительное сырьё – воздух (кислород), катализатор( V2O5), 98% H2SO4.
Слайд 4Химические реакции
Подбор оптимальных условий производства серной кислоты осуществляют,
исходя из характеристики химических реакций:
FeS2→SO2→SO3→H2SO4
FeS2→SO2→SO3→H2SO4
Слайд 51.Получение SO2. Обжиг пирита
4 FeS2 + 11 O2 = 2 Fe2O3
+ 8 SO2 +Q
(реакция необратимая, экзотермическая, гетерогенная,
некаталитическая)
Оптимальные условия:
t =800°С;
проводится в печи для обжига;
реакция ведётся в «кипящем слое»
для увеличения поверхности соприкосновения веществ.
(реакция необратимая, экзотермическая, гетерогенная,
некаталитическая)
Оптимальные условия:
t =800°С;
проводится в печи для обжига;
реакция ведётся в «кипящем слое»
для увеличения поверхности соприкосновения веществ.
Слайд 62. Окисление SO2
V2O5
2 SO2 + O2 ↔ 2 SO3
(реакция обратимая, экзотермическая, каталитическая, гетерогенная(катализатор - твёрдое вещество)
Оптимальные условия:
t нач.=600°С, потом понижение t до 400-450 °С;
катализатор V2O5;
повышенное давление;
предварительно SO2 очистить
2 SO2 + O2 ↔ 2 SO3
(реакция обратимая, экзотермическая, каталитическая, гетерогенная(катализатор - твёрдое вещество)
Оптимальные условия:
t нач.=600°С, потом понижение t до 400-450 °С;
катализатор V2O5;
повышенное давление;
предварительно SO2 очистить
Слайд 73. Поглощение SO3 водой
SO3 + H2O = H2SO4 + Q
(реакция необратимая,
экзотермическая,
некаталитическая, гетерогенная)
Оптимальные условия:
t = 300°С;
применяются керамические кольца
для увеличения поверхности соприкосновения;
поглощение SO3 идёт не водой, а H2SO4 (к),т.к. обр.сернокислотный туман.
В результате образуется олеум 98% серная кислота.
некаталитическая, гетерогенная)
Оптимальные условия:
t = 300°С;
применяются керамические кольца
для увеличения поверхности соприкосновения;
поглощение SO3 идёт не водой, а H2SO4 (к),т.к. обр.сернокислотный туман.
В результате образуется олеум 98% серная кислота.
Слайд 8В ходе исследований мы выявили следующие научные принципы, лежащие в основе
производства H2SO4
Непрерывность реакций. Подбор оптимальных условий.
Принцип утилизации теплоты реакции.
Принцип противотока
Охрана окружающей среды.
Принцип использования отходов производства
Слайд 10
Технологические процессы
1) Тепловые (нагревание смеси, охлаждение).
2) Гидродинамические (перемещение газов и
жидкостей по трубам, смешивание газов, очистка газов).
3) Диффузионные (ректификация).
4) Химические (горение топлива);
3) Диффузионные (ректификация).
4) Химические (горение топлива);
Слайд 11
Экологические проблемы при производстве H2SO4
Выбросы и отходы сернокислотных заводов вызывают крайне
негативное воздействие на окружающую среду:
Увеличение заболеваний дыхательной системы у человека и животных;
Гибель растительности и подавление её роста;
Повышение коррозионного износа материалов;
Разрушение сооружений из известняка и мрамора;
Закисление почв и др.
Увеличение заболеваний дыхательной системы у человека и животных;
Гибель растительности и подавление её роста;
Повышение коррозионного износа материалов;
Разрушение сооружений из известняка и мрамора;
Закисление почв и др.