- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Предельные углеводороды. Алканы. (9 класс)
Содержание
- 1. Презентация по химии Предельные углеводороды. Алканы. (9 класс)
- 2. Предельные углеводородыСогласно Международной номенклатуре предельные углеводороды называют
- 3. Общая формула алкановCnH2n+2
- 4. Слайд 4
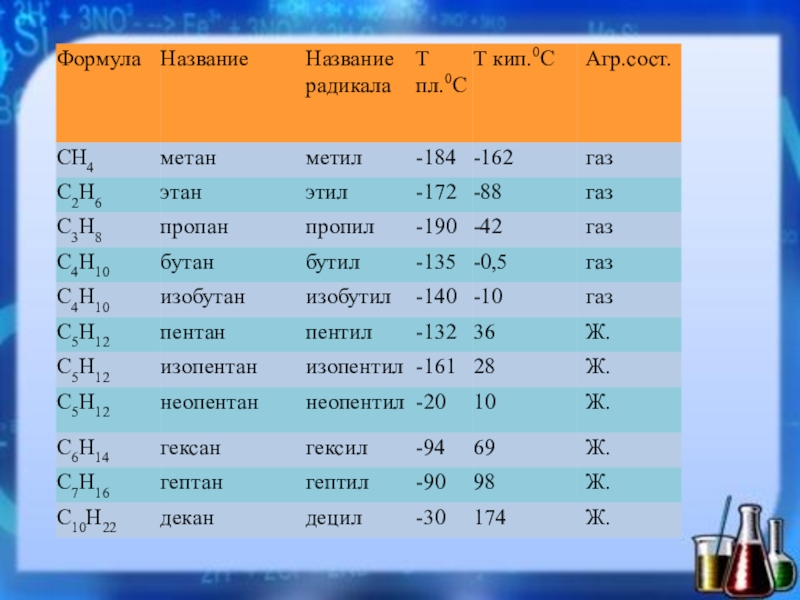
- 5. Физические свойстваПервые четыре члена гомологического ряда метана
- 6. Получение алкановДля получения алканов используют в основном
- 7. Химические свойства алканов1. Реакции замещения - Галогенирование (протекает в несколько стадий) CH4 + Cl2 hν → CH3Cl(хлорметан) + HCl -1ст. CH3Cl + Cl2 hν → CH2Cl2 (дихлорметан)+ HCl -2ст. H2Cl2 + Cl2 hν → CHCl3 (трихлорметан)+ HCl -3ст. CHCl3 + Cl2 hν → CCl4 (хлорметан)+ HCl -4ст.
- 8. Химические свойства алканов2. Реакции горения (горят светлым не коптящим пламенем) CnH2n+2 + O2 t→ nCO2 + (n+1)H2O
- 9. Химические свойства алканов3. Реакции разложенияа) Крекинг при температуре 700-1000°С
- 10. ПрименениеИспользование в качестве топлива – в котельных
- 11. Задания для закрепленияОсуществите превращения по схеме, назовите
- 12. Реши кроссвордПо горизонтали:Алкан, имеющий молекулярную формулу С3Н8.
Предельные углеводородыСогласно Международной номенклатуре предельные углеводороды называют алканами. Алканы - алифатические предельные углево- дороды, в молекулах которых атомы углерода связаны между собой простой σ-связью.
Слайд 1Предельные углеводороды. Физические и химические свойства. Применение.
§ 51,52пересказ, выучить алканы
Слайд 2Предельные углеводороды
Согласно Международной номенклатуре предельные углеводороды называют алканами.
Алканы - алифатические
предельные углево- дороды, в молекулах которых атомы углерода связаны между собой простой σ-связью.
Слайд 5Физические свойства
Первые четыре члена гомологического ряда метана — газообразные вещества, начиная
с пентана — жидкости, а углеводороды с числом углеродных атомов 16 и выше — твердые вещества (при обычной температуре).
неполярные соединения и трудно поляризуемые.
легче воды и в ней практически не растворяются.
горючие вещества.
Метан и этан, а также высшие алканы не имеют запаха. Метан горит бесцветным пламенем.
Жидкие алканы — хорошие растворители для многих органических веществ.
неполярные соединения и трудно поляризуемые.
легче воды и в ней практически не растворяются.
горючие вещества.
Метан и этан, а также высшие алканы не имеют запаха. Метан горит бесцветным пламенем.
Жидкие алканы — хорошие растворители для многих органических веществ.
Слайд 6Получение алканов
Для получения алканов используют в основном природные источники.
Газообразные алканы получают
из природного и попутных нефтяных газов, а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск —природный битум.
1. Из простых веществ:
nC + 2nН2 500 °С, кат → СnН2n + 2
2. Действие металлического натрия на галогенопроизводные алканов—реакция А.Вюрца:
2CH3-Cl + 2Na → CH3-CH3 + 2NaCl
Слайд 7Химические свойства алканов
1. Реакции замещения - Галогенирование (протекает в несколько стадий)
CH4 + Cl2 hν → CH3Cl(хлорметан)
+ HCl -1ст.
CH3Cl + Cl2 hν → CH2Cl2 (дихлорметан)+ HCl -2ст.
H2Cl2 + Cl2 hν → CHCl3 (трихлорметан)+ HCl -3ст.
CHCl3 + Cl2 hν → CCl4 (хлорметан)+ HCl -4ст.
CH3Cl + Cl2 hν → CH2Cl2 (дихлорметан)+ HCl -2ст.
H2Cl2 + Cl2 hν → CHCl3 (трихлорметан)+ HCl -3ст.
CHCl3 + Cl2 hν → CCl4 (хлорметан)+ HCl -4ст.
Слайд 8Химические свойства алканов
2. Реакции горения (горят светлым не коптящим пламенем)
CnH2n+2 +
O2 t→ nCO2 + (n+1)H2O
Слайд 9Химические свойства алканов
3. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
C10H22 → C5H12 + C5H10
б) Пиролиз при температуре 1000°С разрываются все связи, продукты – С (сажа) и Н2:
СH4 1000°С→ C + 2H2
б) Пиролиз при температуре 1000°С разрываются все связи, продукты – С (сажа) и Н2:
СH4 1000°С→ C + 2H2
Слайд 10Применение
Использование в качестве топлива – в котельных установках, бензин, дизельное топливо,
авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит
Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках
Метан используется для производства шин и краски
Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках
Метан используется для производства шин и краски
Слайд 11Задания для закрепления
Осуществите превращения по схеме, назовите продукты:
C→ CH4 → CH3Cl → C2H6 → CO2
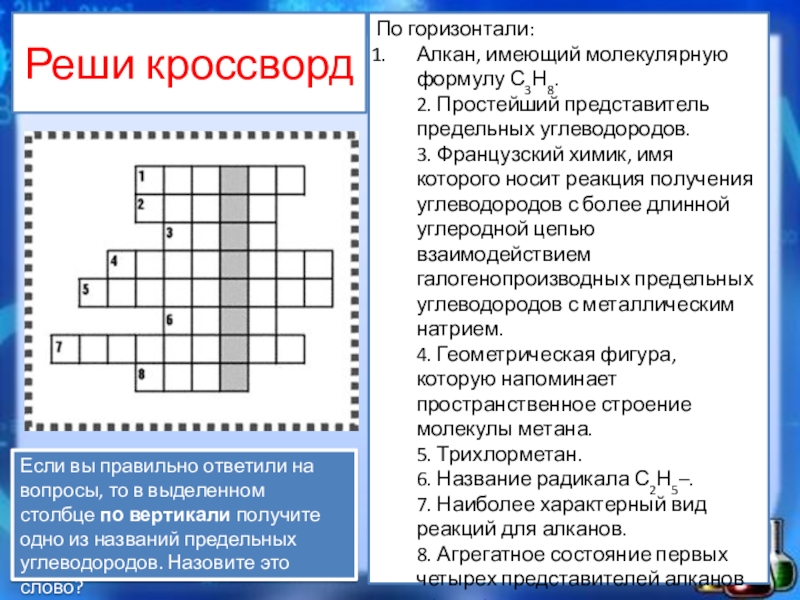
Слайд 12Реши кроссворд
По горизонтали:
Алкан, имеющий молекулярную формулу С3Н8.
2. Простейший представитель предельных углеводородов.
3.
Французский химик, имя которого носит реакция получения углеводородов с более длинной углеродной цепью взаимодействием галогенопроизводных предельных углеводородов с металлическим натрием.
4. Геометрическая фигура, которую напоминает пространственное строение молекулы метана.
5. Трихлорметан.
6. Название радикала С2Н5–.
7. Наиболее характерный вид реакций для алканов.
8. Агрегатное состояние первых четырех представителей алканов при нормальных условиях.
Если вы правильно ответили на вопросы, то в выделенном столбце по вертикали получите одно из названий предельных углеводородов. Назовите это слово?