пробирок.
Реактивы: согласно методичке.
Цель работы: научиться
1.распознавать вещества С ПОМОЩЬЮ КАЧЕСТВЕННЫХ РЕАКЦИЙ
2. проводить экспериментальные доказательства
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Практическая работа № 6 Ионные реакции
Содержание
- 1. Презентация по химии Практическая работа № 6 Ионные реакции
- 2. Техника безопасности Если в руках у вас
- 3. ПРАВИЛА ВЫЖИВАНИЯ = ЗДРАВЫЙ СМЫСЛ + ТБ
- 4. инструктаж по правилам техники безопасности1. работа с
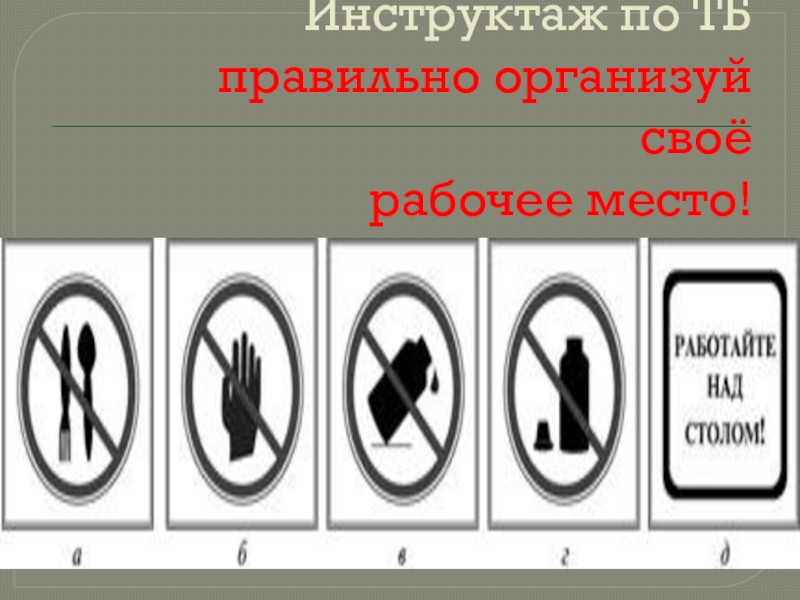
- 5. Инструктаж по ТБ правильно организуй
- 6. вещества
- 7. Определение запаха
- 8. Работа со штативом
- 9. Работа со спиртовкой строение спиртовки 1.
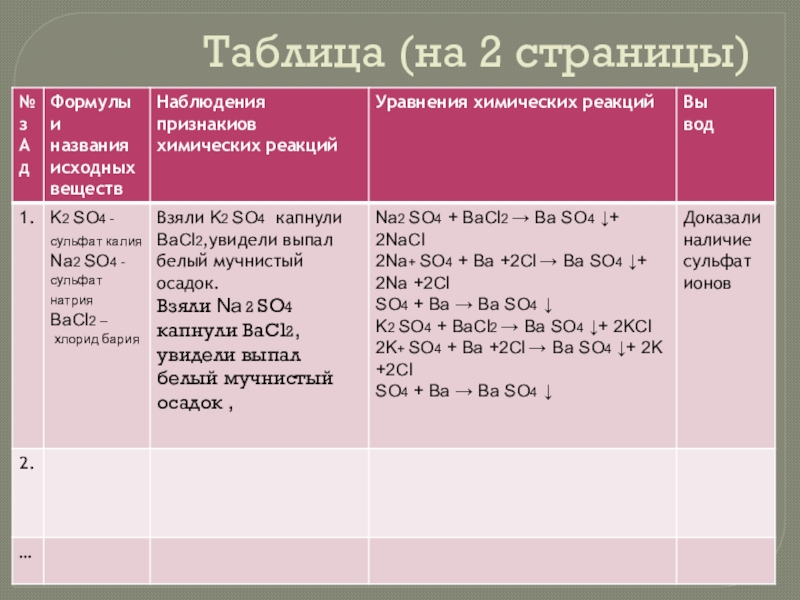
- 10. Таблица (на 2 страницы)
- 11. Опыт 11).Na2 SO4 + BaCl2 → Ba
- 12. Опыт 2NaCl + AgNO3 →Ag Cl ↓
- 13. Опыт 31. эталон должен остаться чистым2. сделать пробы для работы3. Таблица чертится на 2 страницы
- 14. Опыт 3KCl ? MgSO4?1. Сделаем пробы2. добавим
- 15. Опыт 3KCl ? MgSO4?1).Mg SO4 + BaCl2
- 16. Опыт 3Вариант1
- 17. Опыт 4a) BaCl21.BaCl2 + K2 SO4 →
- 18. Опыт 4b) Mg SO4 1).Mg SO4 +
- 19. Опыт 4 в)NH4CO31). 2NH4CO3 +2 KOH →
- 20. СПАСИБО ЗА РАБОТУСОГЛАСНО ПРАВИЛАМ ТЕХНИКИ БЕЗОПАСНОСТИ!
- 21. Инструкция по окончанию работы1. Приведи в порядок
Техника безопасности Если в руках у вас жидкое - не разлейте,
Слайд 18кл.Практическая работа №6 «Ионные реакции»
Оборудование: пробирки, штатив химический, спиртовка,спички, держатель для
Слайд 2Техника безопасности
Если в руках у вас жидкое - не разлейте,
порошкообразное - не рассыпьте, газообразное - не выпустите наружу.
Если включили - выключите.
Если открыли - закройте.
Если разобрали - соберите.
Если вы не можете собрать - позовите на помощь умельца.
Если вы не разбирали - не вздумайте собирать.
Если вы одолжили что-нибудь - верните.
Если вы пользуетесь чем-либо, держите в чистоте и порядке.
Если вы привели что-либо в беспорядок - восстановите статус кво.
Если вы сдвинули что-нибудь - верните на место.
Если вы хотите воспользоваться чем-либо, принадлежащим другому, попросите разрешения.
Если вы не знаете, как это действует, ради бога, не трогайте.
Если вас это не касается - не вмешивайтесь.
Если вы не знаете, как это делается - сразу спросите.
Слайд 3ПРАВИЛА ВЫЖИВАНИЯ = ЗДРАВЫЙ СМЫСЛ + ТБ
ЕСЛИ НЕ УСВОИЛИ ЭТИХ ПРАВИЛ,
НЕ ВХОДИТЕ В ЛАБОРАТОРИЮ.
Слайд 4инструктаж по правилам техники безопасности
1. работа с кислотами, щелочами, солями
2. работа
с пузырьками и капельницами
3. работа со спиртовкой
4. нагревание веществ
5. организация рабочего места
3. работа со спиртовкой
4. нагревание веществ
5. организация рабочего места
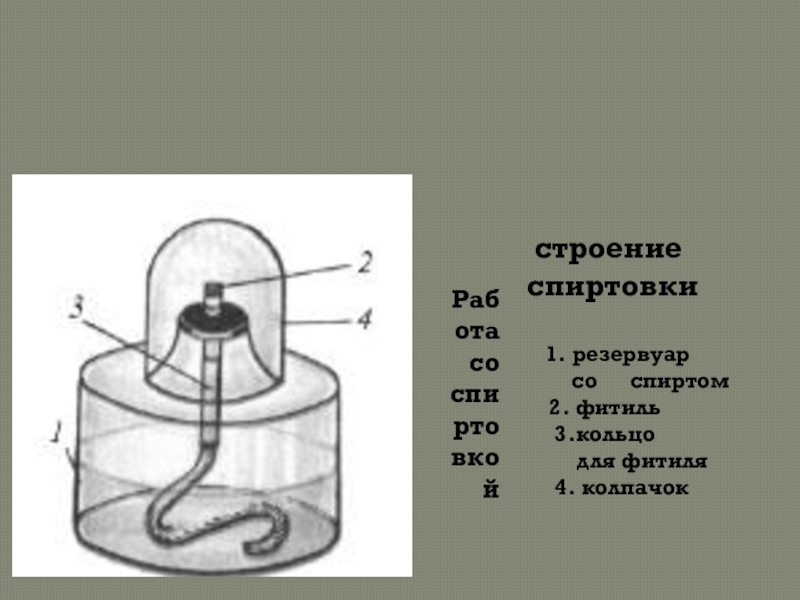
Слайд 9Работа со спиртовкой
строение спиртовки
1. резервуар
со спиртом
2. фитиль
3.кольцо
для фитиля
4. колпачок
2. фитиль
3.кольцо
для фитиля
4. колпачок
Слайд 11Опыт 1
1).Na2 SO4 + BaCl2 → Ba SO4 ↓+ 2NaCl
2Na+ SO4
+ Ba +2Cl → Ba SO4 ↓+ 2Na +2Cl
SO4 + Ba → Ba SO4 ↓
2).K2 SO4 + BaCl2 → Ba SO4 ↓+ 2KCl
2K+ SO4 + Ba +2Cl → Ba SO4 ↓+ 2K +2Cl
SO4 + Ba → Ba SO4 ↓
SO4 + Ba → Ba SO4 ↓
2).K2 SO4 + BaCl2 → Ba SO4 ↓+ 2KCl
2K+ SO4 + Ba +2Cl → Ba SO4 ↓+ 2K +2Cl
SO4 + Ba → Ba SO4 ↓
Слайд 13Опыт 3
1. эталон должен остаться чистым
2. сделать пробы для работы
3. Таблица
чертится на 2 страницы
Слайд 14Опыт 3
KCl ? MgSO4?
1. Сделаем пробы
2. добавим в обе пробы BaCl2
3. наблюдаем выпадение белого мучнистого осадка
Ba SO4 ↓ в одной из пробирок ,
значит в этой пробирке сульфат магния MgSO4
4. Снова сделаем пробу из нераспознанной пробирки и добавим в неё AgNO3
5. наблюдаем выпадение белого творожистого осадка
Ag Cl ↓,
значит это хлорид калия KCl
Слайд 15Опыт 3
KCl ? MgSO4?
1).Mg SO4 + BaCl2 → Ba SO4 ↓+
MgCl2
Mg+ SO4 + Ba +2Cl → Ba SO4 ↓+ Mg +2Cl
SO4 + Ba → Ba SO4 ↓
2). KCl + AgNO3 →Ag Cl ↓ +KNO3
K +Cl + Ag +NO3 →AgCl ↓ +K +NO3
Ag + Cl → AgCl ↓
Mg+ SO4 + Ba +2Cl → Ba SO4 ↓+ Mg +2Cl
SO4 + Ba → Ba SO4 ↓
2). KCl + AgNO3 →Ag Cl ↓ +KNO3
K +Cl + Ag +NO3 →AgCl ↓ +K +NO3
Ag + Cl → AgCl ↓
Слайд 16Опыт 3
Вариант1
вариант2
KCl № 1 KCl № 2
MgSO4 № 2 MgSO4 №1
Вариант3 вариант4
KCl № 1 KCl № 2
MgSO4 № 2 MgSO4 №1
KCl № 1 KCl № 2
MgSO4 № 2 MgSO4 №1
Вариант3 вариант4
KCl № 1 KCl № 2
MgSO4 № 2 MgSO4 №1
Слайд 17Опыт 4
a) BaCl2
1.BaCl2 + K2 SO4 → Ba SO4 ↓+ 2KCl
Ba
+2Cl +2 K+ SO4 → Ba SO4 ↓+ 2K+2Cl
SO4 + Ba → Ba SO4 ↓
2.BaCl2 + 2AgNO3 →2Ag Cl ↓ + Ba( NO3)2
Ba+2Cl+ 2Ag+2NO3 →2Ag Cl ↓+ Ba +2 NO3
Ag + Cl → AgCl ↓
SO4 + Ba → Ba SO4 ↓
2.BaCl2 + 2AgNO3 →2Ag Cl ↓ + Ba( NO3)2
Ba+2Cl+ 2Ag+2NO3 →2Ag Cl ↓+ Ba +2 NO3
Ag + Cl → AgCl ↓
Слайд 18Опыт 4
b) Mg SO4
1).Mg SO4 + BaCl2 → Ba SO4
↓+ MgCl2
Mg+ SO4 + Ba +2Cl → Ba SO4 ↓+ Mg +2Cl
SO4 + Ba → Ba SO4 ↓
2). Mg SO4 +2 KOH → Mg(OH)2 ↓ + K2 SO4
Mg+SO4 +2K+2OH →Mg(OH)2 ↓ + 2K+ SO4
Mg+2OH →Mg(OH)2 ↓
Mg+ SO4 + Ba +2Cl → Ba SO4 ↓+ Mg +2Cl
SO4 + Ba → Ba SO4 ↓
2). Mg SO4 +2 KOH → Mg(OH)2 ↓ + K2 SO4
Mg+SO4 +2K+2OH →Mg(OH)2 ↓ + 2K+ SO4
Mg+2OH →Mg(OH)2 ↓
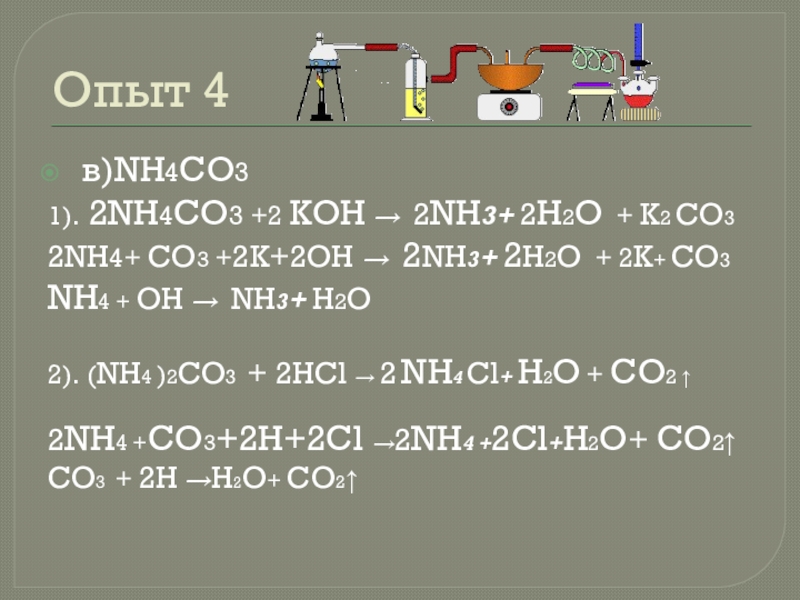
Слайд 19Опыт 4
в)NH4CO3
1). 2NH4CO3 +2 KOH → 2NH3+ 2H2O + K2
CO3
2NH4+ CO3 +2K+2OH → 2NH3+ 2H2O + 2K+ CO3
NH4 + OH → NH3+ H2O
2). (NH4 )2CO3 + 2HCl → 2 NH4 Cl+ H2O + CO2 ↑
2NH4 +CO3+2H+2Cl →2NH4 +2Cl+H2O+ CO2↑
CO3 + 2H →H2O+ CO2↑
2NH4+ CO3 +2K+2OH → 2NH3+ 2H2O + 2K+ CO3
NH4 + OH → NH3+ H2O
2). (NH4 )2CO3 + 2HCl → 2 NH4 Cl+ H2O + CO2 ↑
2NH4 +CO3+2H+2Cl →2NH4 +2Cl+H2O+ CO2↑
CO3 + 2H →H2O+ CO2↑
Слайд 21Инструкция по окончанию работы
1. Приведи в порядок рабочее место:
Расположи оборудование и
реактивы так, как они располагались до начала работы
Вытри пролитое, собери просыпанное
Закрой плотно спиртовку во избежание испарения спирта из неё
Закрой все пробки на флаконах с реактивами и поставь их в должном порядке
Вымой тщательно пробирки
2. Собери мусор и выбрось его в контейнер с мусором в коридоре.
3. Сдай штатив физический в вытяжной шкаф
4. Лоток с оборудованием поставь на полку в стенке согласно маркировке
5. Пропуск вложи в тетрадь, а тетрадь вложи в тетрадь соседа и сдайте учителю
Вытри пролитое, собери просыпанное
Закрой плотно спиртовку во избежание испарения спирта из неё
Закрой все пробки на флаконах с реактивами и поставь их в должном порядке
Вымой тщательно пробирки
2. Собери мусор и выбрось его в контейнер с мусором в коридоре.
3. Сдай штатив физический в вытяжной шкаф
4. Лоток с оборудованием поставь на полку в стенке согласно маркировке
5. Пропуск вложи в тетрадь, а тетрадь вложи в тетрадь соседа и сдайте учителю