- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии по темеАлкины
Содержание
- 1. Презентация по химии по темеАлкины
- 2. ГОМОЛОГИЧЕСКИЙ РЯД АЛКИНОВОбщая формула CnH2n+2Суффикс ин1.------2. этин
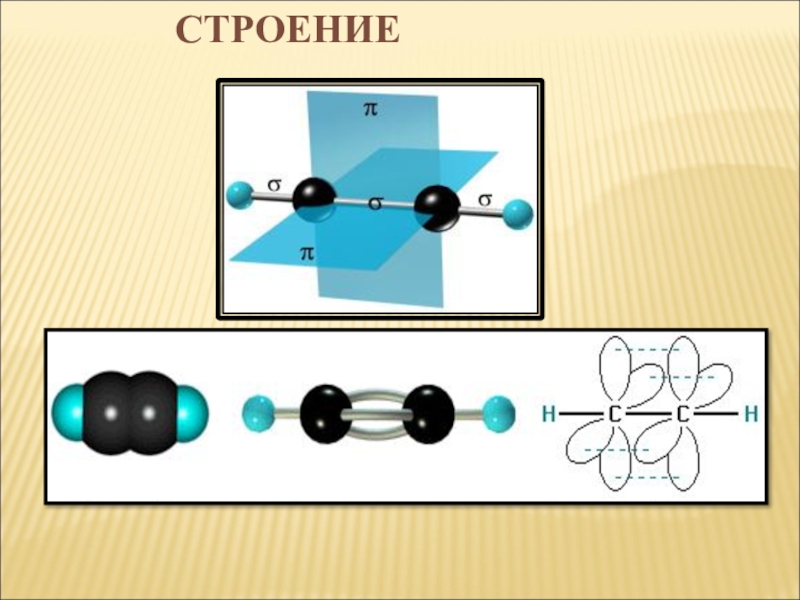
- 3. СТРОЕНИЕ
- 4. Слайд 4
- 5. Слайд 5
- 6. СТРОЕНИЕ
- 7. Слайд 7
- 8. ИЗОМЕРИЯ АЛКИНОВ 1) изомерия углеродного скелета
- 9. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКИНОВ
- 10. ПОЛУЧЕНИЕ АЛКИНОВ 1) В промышленности ацетилен получаютвысокотемпературным пиролизом
- 11. ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВРеакции присоединения
- 12. 2) Галогенирование. Алкины обесцвечивают
- 13. 4) Гидратация (+Н₂О) В
- 14. Окисление 6) Горение Горят коптящим пламенем.
- 15. ПРИМЕНЕНИЕ АЛКЕНОВ 1. Алкены широко используются
- 16. ПРИМЕНЕНИЕ АЛКИНОВ 3. При
ГОМОЛОГИЧЕСКИЙ РЯД АЛКИНОВОбщая формула CnH2n+2Суффикс ин1.------2. этин С₂Н₂ ацетилен3. пропин С₃Н₄4. бутин С₄Н₆5. пентин С₅Н₈6. гексин С₆Н₁₀
Слайд 2ГОМОЛОГИЧЕСКИЙ РЯД АЛКИНОВ
Общая формула CnH2n+2
Суффикс ин
1.------
2. этин С₂Н₂
ацетилен
3. пропин С₃Н₄
4. бутин С₄Н₆
5. пентин С₅Н₈
6. гексин С₆Н₁₀
3. пропин С₃Н₄
4. бутин С₄Н₆
5. пентин С₅Н₈
6. гексин С₆Н₁₀
Слайд 5
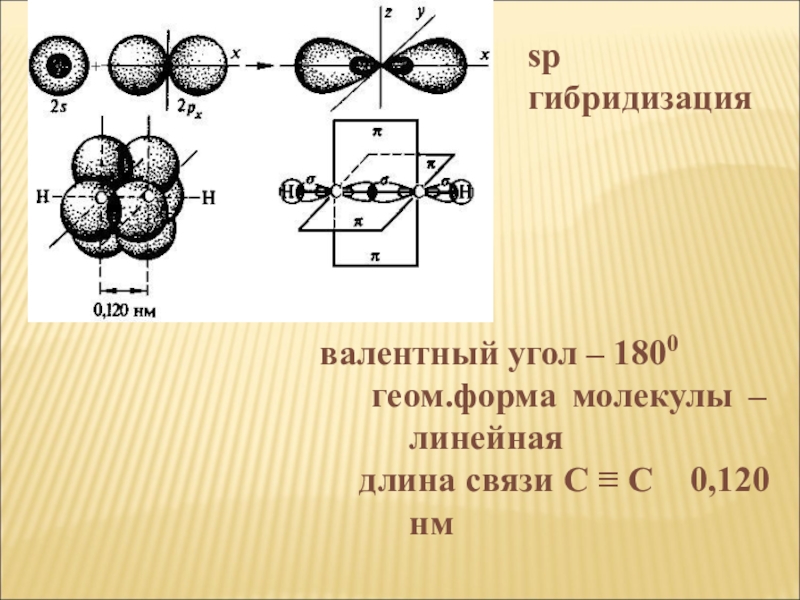
валентный
угол – 1800
геом.форма молекулы – линейная
длина связи С ≡ С 0,120 нм
геом.форма молекулы – линейная
длина связи С ≡ С 0,120 нм
sp
гибридизация
Слайд 7 НОМЕНКЛАТУРА
Название алкинов по
систематической
номенклатуре образуют из названий алканов
суффикс –ан меняем на –ин
Главная цепь атомов углерода должна
обязательно включать тройную связь,
и ее нумерацию атомов углерода проводят
с того конца, где ближе тройная связь.
В конце названия цифрой указывается номер
того атома углерода, от которого начинается
тройная связь.
номенклатуре образуют из названий алканов
суффикс –ан меняем на –ин
Главная цепь атомов углерода должна
обязательно включать тройную связь,
и ее нумерацию атомов углерода проводят
с того конца, где ближе тройная связь.
В конце названия цифрой указывается номер
того атома углерода, от которого начинается
тройная связь.
Слайд 8ИЗОМЕРИЯ АЛКИНОВ
1) изомерия углеродного скелета (начиная с C5H8)
CH≡C-CH2-CH2-CH3 CH≡C- CH(CH3)- CH3
пентин-1 3-метилбутин-1
2) изомерия положения тройной связи (начиная с C4H6)
CH≡C-CH2-CH2-CH3 CH3-C≡C-CH2-CH3
пентин-1 пентин-2
3) межклассовая изомерия (алкадиены). CH≡C-CH2-CH2-CH3 CH2=CH-CH=CH-CH3
пентин-1 пентадиен-1,3
пентин-1 3-метилбутин-1
2) изомерия положения тройной связи (начиная с C4H6)
CH≡C-CH2-CH2-CH3 CH3-C≡C-CH2-CH3
пентин-1 пентин-2
3) межклассовая изомерия (алкадиены). CH≡C-CH2-CH2-CH3 CH2=CH-CH=CH-CH3
пентин-1 пентадиен-1,3
Слайд 9ФИЗИЧЕСКИЕ СВОЙСТВА АЛКИНОВ
По физическим свойствам
алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы.
В обычных условиях алкины
С2–С3 – газы,
С4–С16 – жидкости,
высшие алкины – твердые вещества.
Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами.
В обычных условиях алкины
С2–С3 – газы,
С4–С16 – жидкости,
высшие алкины – твердые вещества.
Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами.
Слайд 10ПОЛУЧЕНИЕ АЛКИНОВ
1) В промышленности ацетилен получают
высокотемпературным пиролизом метана.
1500ºС
2CH4 → HC≡CH + 3H2
2) Дегидрирование алканов
CH3 – CH3 ↔ 2H2 + CH ≡ CH
3) Ацетилен получают карбидным способом при разложении карбида кальция водой.
CaC2 + 2H2O → Ca(OH)2 + HC≡CH
2CH4 → HC≡CH + 3H2
2) Дегидрирование алканов
CH3 – CH3 ↔ 2H2 + CH ≡ CH
3) Ацетилен получают карбидным способом при разложении карбида кальция водой.
CaC2 + 2H2O → Ca(OH)2 + HC≡CH
Слайд 11ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ
Реакции присоединения
1) Гидрирование +Н₂
осуществляется при нагревании с металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
CH≡CH + H2 → CH₂=CH2
этин этен
CH₂=CH2 + H2 → CH3–CH3
этен этан
CH≡CH + H2 → CH₂=CH2
этин этен
CH₂=CH2 + H2 → CH3–CH3
этен этан
Слайд 12 2) Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция
на тройную связь). Реакция галогенирования алкинов протекает медленнее, чем алкенов.
HC≡CH + Br2 → CHBr=CHBr
этин 1,2 дибромэтен
CHBr=CHBr + Br2 → CHBr2–CHBr₂
1,1,2,2-тетрабромэтан
3) Гидрогалогенирование. Образующиеся продукты определяются правилом Марковникова. CH3–C≡CH + HBr → CH3–CBr=CH2
2-бромпропен-1
CH3–CBr=CH2 + HBr → CH3–CBr2–CH3
2,2 дибромпропан
HC≡CH + Br2 → CHBr=CHBr
этин 1,2 дибромэтен
CHBr=CHBr + Br2 → CHBr2–CHBr₂
1,1,2,2-тетрабромэтан
3) Гидрогалогенирование. Образующиеся продукты определяются правилом Марковникова. CH3–C≡CH + HBr → CH3–CBr=CH2
2-бромпропен-1
CH3–CBr=CH2 + HBr → CH3–CBr2–CH3
2,2 дибромпропан
Слайд 134) Гидратация (+Н₂О)
В случае гидратации собственно ацетилена
конечным продуктом является уксусный альдегид.
HC≡CH + H2O ––HgSO4→ CH3 – CH = O
5) Тримеризация (для ацетилена)
Cакт.,t
3СH≡CH → С6Н6 (бензол)
HC≡CH + H2O ––HgSO4→ CH3 – CH = O
5) Тримеризация (для ацетилена)
Cакт.,t
3СH≡CH → С6Н6 (бензол)
Слайд 14Окисление
6) Горение
Горят коптящим пламенем. При вдувании кислорода
- светятся, t = 2500ºC.
2C2H2 + 5O2 → 4CO2 + 2H2O +Q
7) В присутствии перманганата калия ацетилен легко окисляется в до щавелевой кислоты (обесцвечивание раствора KMnO4 является качественной реакцией на наличие тройной связи).
3C2H2 + 8KMnO4 + 4H2O → 3HOOC-COOH + +8MnO2 + 8KOH
2C2H2 + 5O2 → 4CO2 + 2H2O +Q
7) В присутствии перманганата калия ацетилен легко окисляется в до щавелевой кислоты (обесцвечивание раствора KMnO4 является качественной реакцией на наличие тройной связи).
3C2H2 + 8KMnO4 + 4H2O → 3HOOC-COOH + +8MnO2 + 8KOH
Слайд 15ПРИМЕНЕНИЕ АЛКЕНОВ
1. Алкены широко используются в промышленности в качестве исходных
веществ для получения растворителей (спирты, дихлорэтан, эфиры гликолей уксусной кислоты, 1,1,2,2- тетрахлорэтана.
2. Получение полимеров (полиэтилен, поливинилхлорид, полиизобутилен и др.)
2. Получение полимеров (полиэтилен, поливинилхлорид, полиизобутилен и др.)
Слайд 16ПРИМЕНЕНИЕ АЛКИНОВ
3. При горении ацетилена в кислороде
температура пламени достигает 3150°C, поэтому ацетилен используют для резки и сварки металлов.