- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии по теме Металлы
Содержание
- 1. Презентация по химии по теме Металлы
- 2. Металлы - это элементы, атомы которых отдают свои внешние электроны и практически не обладают способностью присоединять электроны
- 3. Металлам характерно:Небольшое число электронов на внешнем слое;Сравнительно
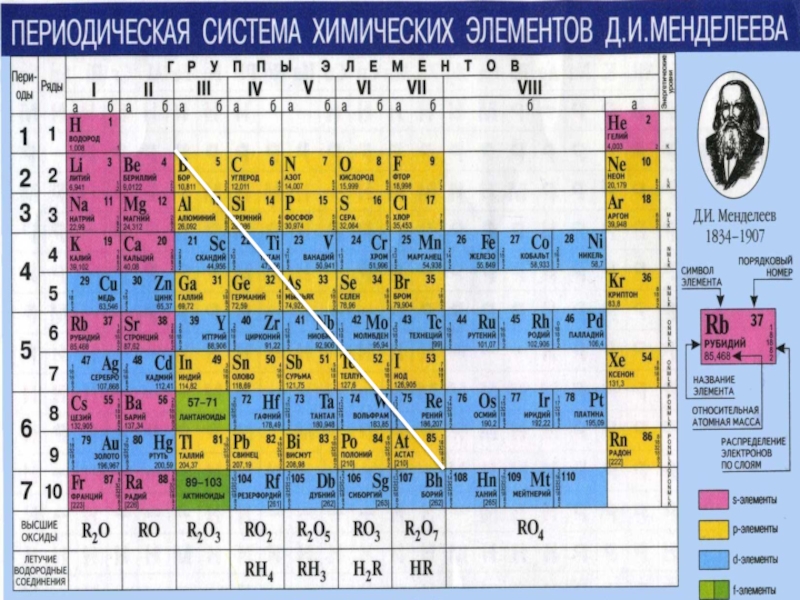
- 4. Слайд 4
- 5. Физические свойства металловАгрегатное состояние – твердые (ртуть
- 6. Физические свойства металлов5. Температура плавления и кипения:Легкоплавкие (tпл˂1000
- 7. Металлы в природе. Способы получения металлов.
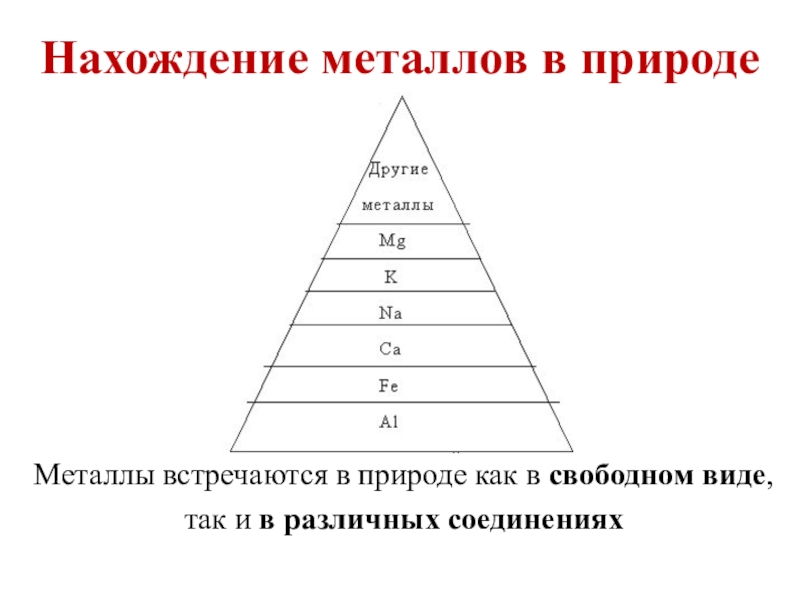
- 8. Металлы встречаются в природе как в свободном виде, так и в различных соединенияхНахождение металлов в природе
- 9. Металлы в природе1) Самородки (медь, золото, серебро,
- 10. б) Соли неорганических кислот Сульфиды: галенит PbS,
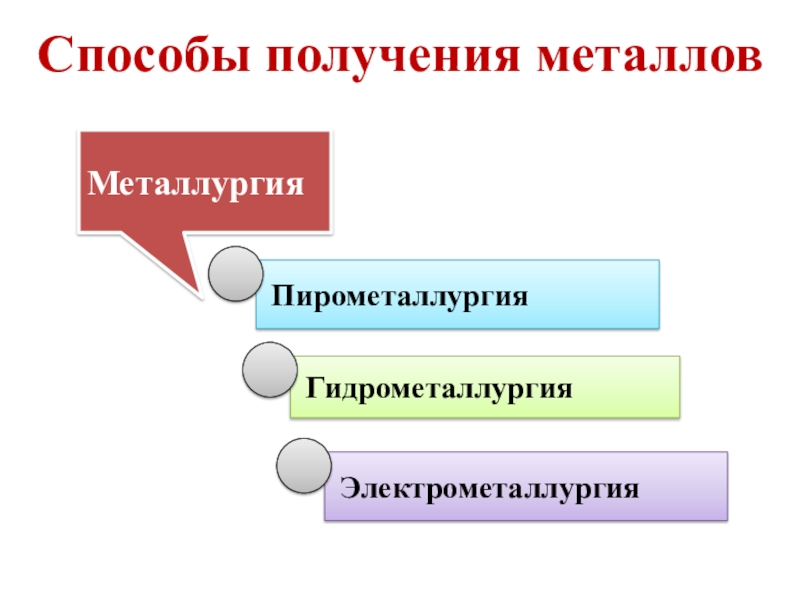
- 11. Способы получения металлов
- 12. Пирометаллургия - получение металлов и сплавов под
- 13. Гидрометаллургия - получение металлов из водных растворов
- 14. Слайд 14
- 15. Химические свойства металловярко выраженные восстановительные свойства.По активности
- 16. 1. Взаимодействие с простыми веществами: а) С кислородом
- 17. г) с водородом самые активные металлы образуют
- 18. 2. Взаимодействие со сложными веществами:а) металлы (от
- 19. б) металлы, расположенные в ряду напряжений до
Слайд 2Металлы
- это элементы, атомы которых отдают свои внешние электроны и практически
Слайд 3Металлам характерно:
Небольшое число электронов на внешнем слое;
Сравнительно большой радиус атомов;
Восстановительные свойства:
Характерные связи для металлов: ионная и металлическая.
Слайд 5Физические свойства металлов
Агрегатное состояние – твердые (ртуть – жидкая при н.у.)
Цвет:
Черные;
Цветные.
Металлический
Электро- и теплопроводность
(лучшие проводники электрического тока — серебро, медь, железо, алюминий. Худшие проводники — ртуть, свинец, вольфрам).
Слайд 6Физические свойства металлов
5. Температура плавления
и кипения:
Легкоплавкие
(tпл˂1000 ˚С)
Тугоплавкие
(tпл ˃ 1000 ˚С)
Пластичность,
7. Плотность
легкие (с плотностью до 5 г/cм3)
тяжелые (с плотностью больше 5 г/см3)
8. Обладают магнитными свойствами
9. Звенят
Слайд 8Металлы встречаются в природе как в свободном виде, так и в
Нахождение металлов в природе
Слайд 9Металлы в природе
1) Самородки (медь, золото, серебро, платина, иногда ртуть);
2) Соединения
а) Оксиды (магнетит Fe3O4, гематит Fe2О3 ; каолин Аl2O3•2SiO2•2Н2О,
алунит (Na,K)2O•Аl2О3•2SiO2 и другие)
Слайд 10б) Соли неорганических кислот
Сульфиды: галенит PbS, киноварь НgS, серный колчедан
Хлориды: сильвин (KCl), галит (NaCl) и сильвинит (КСl•NаСl)
Сульфаты: глауберова соль Nа2SO4•2Н2О, гипс CaSO4•2H2O, барит ВaSO4
Карбонаты: мел, мрамор, известняк СаСО3, магнезит МgСО3
Фосфаты: апатит Са3(РО4)2
Слайд 12Пирометаллургия - получение металлов и сплавов под действием высоких температур с
Восстановление углем (угарным газом):
PbO + C = CO2 + Pb
Восстановление алюминием (кальцием):
Al + Fe2O3 = Al2O3 + Fe
Восстановление водородом:
Cr2O3+ H2 = Cr + H2O
Слайд 13Гидрометаллургия - получение металлов из водных растворов солей.
1 стадия: растворение в
CuS + 2HCl = CuCl2 + H2S
2 стадия: вытеснение металлов из растворов их солей более активными металлами:
CuCl2 + Fe = FeCl2 + Cu
Электрометаллургия - получение металлов под действием электрического тока.
Этим способом в промышленности получают металлы, стоящие в ряду напряжений металлов до Al.
NaCl → Na + Cl2
Эл.ток
Слайд 15Химические свойства металлов
ярко выраженные восстановительные свойства.
По активности все металлы делятся на:
Активные
Средней активности – от Mg до Н2;
Малоактивные – после Н2.
Слайд 161. Взаимодействие с простыми веществами:
а) С кислородом образуют оксиды:
2Mg + O2 =
б) с галогенами образуют соли – галогениды:
Zn + Br₂= ZnBr₂ бромид цинка
в) с серой образуют соли - сульфиды:
Fe +S = FeS (при нагревании) сульфид железа
Слайд 17г) с водородом самые активные металлы образуют гидриды:
Ca + H₂= CaH₂
д) с углеродом многие металлы образуют карбиды:
Ca + 2C = CaC₂ (при нагревании) карбид кальция
Слайд 182. Взаимодействие со сложными веществами:
а) металлы (от Li до Na), при
2Na + 2H2O = 2NaOH+ H2
Реакция менее активного металла с водой:
3Fe + 4H2O = Fe3O4 + 4H2
Слайд 19б) металлы, расположенные в ряду напряжений до водорода, взаимодействуют с разбавленными
2Al + 6HCl = 2AlCl3+3H2
в) взаимодействие с растворами солей менее активных металлов, образуется соль более активного металла, а менее активный металл выделяется в свободном виде:
Zn + CuCl2 = ZnCl2 + Cu