- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии по теме фосфор
Содержание
- 1. Презентация по химии по теме фосфор
- 2. Фосфор был открыт немецким алхимиком X. Брэндом
- 3. Положение фосфора в ПСХЭ Д.И. Менделеева. Строение
- 4. Сравнение строения атома азота и фосфораNP+7+15) ))
- 5. Нахождение в природе Содержание фосфора в земной
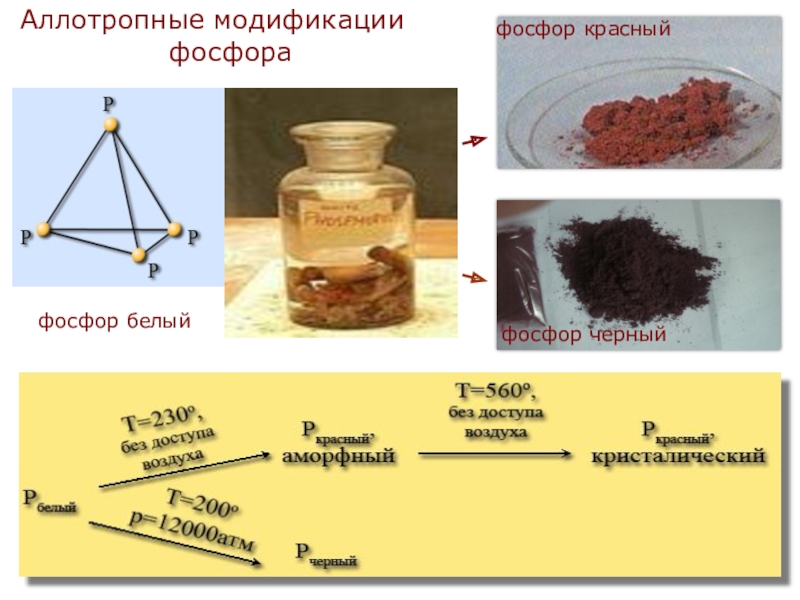
- 6. Аллотропные модификации фосфорафосфор белыйфосфор черныйфосфор красный
- 7. Белый фосфор - твердое кристаллическое вещество, плотность
- 8. Получение фосфораСвободный фосфор получают из природных фосфатов,прокаливая
- 9. Химические свойства фосфораP0P + O2 (S, Cl2)P+5
- 10. I. Взаимодействие фосфора с неметаллами Составьте
- 11. Так же, как с кислородом, фосфор реагирует
- 12. P0 + Cl20 = P+3Cl3–1P0
- 13. III. Взаимодействие фосфора со сложными
- 14. III. Взаимодействие фосфора с металлами Взаимодействие фосфора
- 15. Применение фосфора127893645Белый фосфор применяется для получения красного
- 16. Казахстан по запасам фосфора занимает второе место
- 17. Рост производства фосфорной продукции в Казахстане В
Слайд 2
Фосфор был открыт немецким алхимиком X. Брэндом в 1669 г. Позже
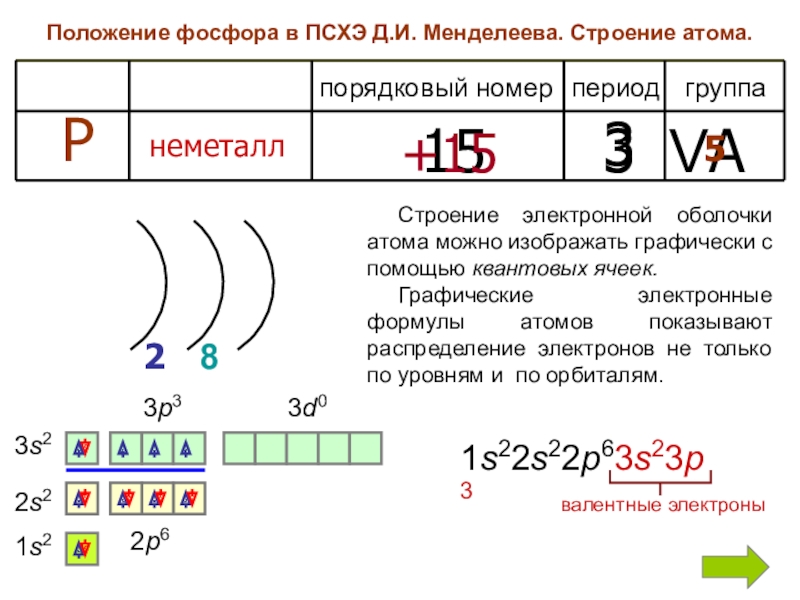
Слайд 3Положение фосфора в ПСХЭ Д.И. Менделеева. Строение атома.
период
группа
порядковый номер
Р
неметалл
15
3
VA
+15
3
2
5
1s2
2s2
2p6
8
3s2
3p3
3d0
Строение
Графические электронные формулы атомов показывают распределение электронов не только по уровням и по орбиталям.
1s22s22p63s23p3
валентные электроны
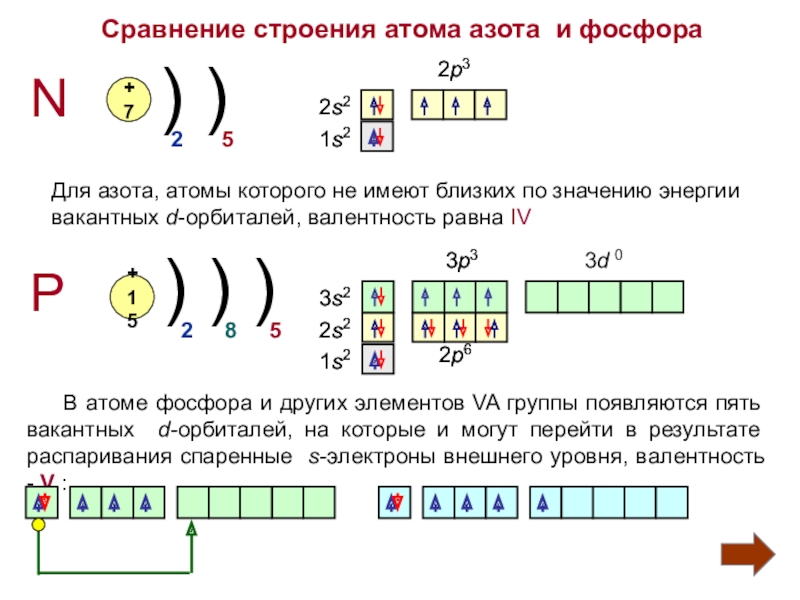
Слайд 4Сравнение строения атома азота и фосфора
N
P
+7
+15
) )
) ) )
2
2
5
8
5
Для азота,
вакантных d-орбиталей, валентность равна IV
1s2
2s2
1s2
2s2
2p3
3p3
2p6
3s2
3d 0
1s2
1s2
2s2
2s2
2p3
2p6
3s2
3p3
В атоме фосфора и других элементов VA группы появляются пять вакантных d-орбиталей, на которые и могут перейти в результате распаривания спаренные s-электроны внешнего уровня, валентность - V :
Слайд 5Нахождение в природе
Содержание фосфора в земной коре составляет 0,093%.
В
Слайд 7Белый фосфор - твердое кристаллическое вещество, плотность его 1,82 г/см3. На
Красный фосфор - порошок темно-красного цвета, плотность его 2,2 г/см3. Получают длительным нагреванием белого фосфора без доступа воздуха при температуре 250-300°С. По своим свойствам отличается от белого, не ядовит.
Черный фосфор - твердое вещество, плотность его 2,7 г/см3. Образуется при нагревании белого фосфора при температуре 200 °С под высоким давлением. Используется в производстве спичек, снарядов и т. д.
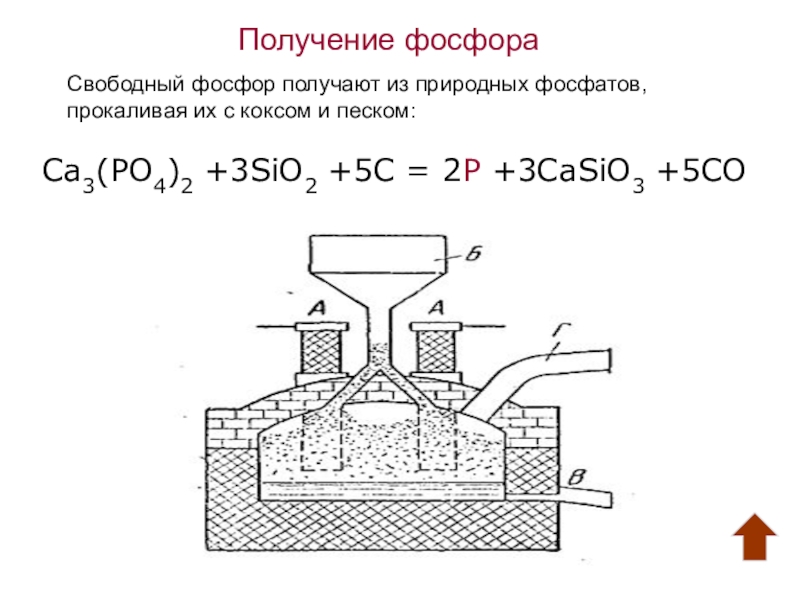
Слайд 8Получение фосфора
Свободный фосфор получают из природных фосфатов,
прокаливая их с коксом и
Ca3(PO4)2 +3SiO2 +5C = 2P +3CaSiO3 +5CO
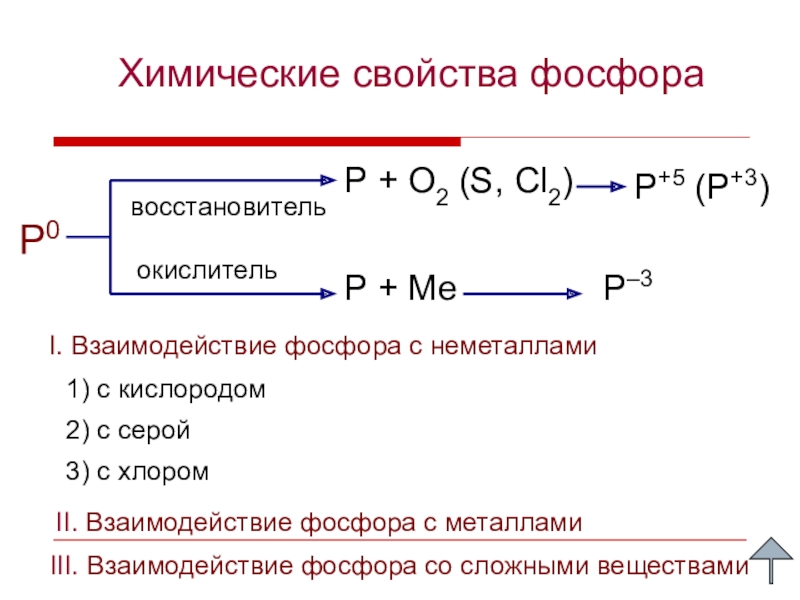
Слайд 9Химические свойства фосфора
P0
P + O2 (S, Cl2)
P+5 (P+3)
восстановитель
окислитель
P + Ме
P–3
1) с
2) с серой
II. Взаимодействие фосфора с металлами
3) с хлором
I. Взаимодействие фосфора с неметаллами
III. Взаимодействие фосфора со сложными веществами
Слайд 10I. Взаимодействие фосфора с неметаллами
Составьте уравнения реакций взаимодействия
P0 + O20 = P2+5O5–2
P0 –5e → P+5 5 4
O20 + 4e → 2O–2 4 5
4
5
2
Р0 – восстановитель, процесс окисления;
О20 – окислитель, процесс восстановления
Опыт №1
Опыт №2
При окислении фосфора в недостатке кислорода образуется Р2О3
4P0 +3O20 =2P2+5O3–2
Взаимодействие фосфора с кислородом
Слайд 11Так же, как с кислородом, фосфор реагирует и с другим халькогеном
P0 + S0 = P2+3S3–2
P0 – 3e → P+3 3 2
S0 + 2e → S–2 2 3
4
3
2
Р0 – восстановитель, процесс окисления;
S0 – окислитель, процесс восстановления
P0 + S0 = P2+5S3–2
P0 – 5e → P+3 5 2
S0 + 2e → S–2 2 5
4
5
2
Р0 – восстановитель, процесс окисления;
S0 – окислитель, процесс восстановления
Слайд 12P0 + Cl20 = P+3Cl3–1
P0 + Cl20 =
P0 –3e → P+3 3 2
Cl20 + 2e → 2Cl–1 2 3
5
2
P0 –5e → P+5 5 2
Cl20 + 2e → 2Cl–1 2 5
2
2
3
При пропускании хлора через трубку с красным фосфором в приемнике собирается бесцветная жидкость – хлорид фосфора (III). В избытке хлора фосфор сгорает бледно-зеленым пламенем с образованием хлорида фосфора (V), которые при охлаждении конденсируются в светло-желтые кристаллы.
Р0 – восстановитель, процесс окисления;
Cl20 – окислитель, процесс восстановления
Р0 – восстановитель, процесс окисления;
Cl20 – окислитель, процесс восстановления
Опыт
2
Слайд 13
III. Взаимодействие фосфора со сложными веществами:
С концентрированными кислотами (азотной
2. Раствором щелочи;
3. Хлоратом калия.
Концентрированные азотная и серная кислоты окисляют фосфор до фосфорной кислоты:
P + 5HNO3 = H3PO4 + 5NO2 + H2O
2P + 5H2SO4= 2H3PO4 + 5SO2 + 2H2O
2. Фосфор, особенно легко белый, вступает в реакцию с горячим
раствором щелочи:
4P + 3NaOH + 3H2O = PH3 + 3NaH2PO2
гипофосфит
натрия
3. В роли окислителя фосфора может быть бертолетова соль (хлорат
калия):
6P + 5KClO3 = 5KCl + 3P2O5
опыт
опыт
Слайд 14III. Взаимодействие фосфора с металлами
Взаимодействие фосфора с кальцием
Опыт
P0 + Ca0 = Ca3+2P2–3
P0 + 3e → P–3 3 2
Ca0 — 2e → Ca+2 2 3
2
3
Р0 – окислитель, процесс восстановления;
Cа0 – восстановитель, процесс окисления.
Слайд 15Применение фосфора
1
2
7
8
9
3
6
4
5
Белый фосфор применяется для получения красного фосфора
Фосфор применяется для получения
производных.
Основная область применения красного фосфора – производство
спичек
Фосфор применяется как раскислитель и компонент некоторых
металлических сплавов
Производство лекарственных
препаратов
Средства борьбы с вредителями
сельского хозяйства
Производство моющих средств
Органический синтез
Р2О5 как осушитель газов и
жидкостей
Слайд 16Казахстан по запасам фосфора занимает второе место в мире после США.
Применение Фосфора. Основная масса производимого Фосфора в Казахстане перерабатывается в фосфорную кислоту и получаемые на ее основе фосфорные удобрения и технические соли (фосфаты). Белый Фосфор используется в зажигательных и дымовых снарядах, бомбах; красный Фосфор - в спичечном производстве. Фосфор применяется в производстве сплавов цветных металлов как раскислитель. Введение до 1% Фосфор увеличивает жаропрочность таких сплавов, как фехраль, хромаль.
Фосфор в организме. Фосфор - один из важнейших биогенных элементов, необходимый для жизнедеятельности всех организмов. Присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных, а также входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, фосфорных эфиров углеводов, многих ферментов и других органических соединений.