- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии по теме этиленовые
Содержание
- 1. Презентация по химии по теме этиленовые
- 2. Слайд 2
- 3. Алкены Алкенами или олефинами,
- 4. Гомологический ряд этиленовыхОбщая формула CnH2n
- 5. Физические свойства.Этиленовые углеводороды близки к алканам. При
- 6. НоменклатураНазвание алкенов по
- 7. 3-этилгептен-23,3-диметилпентен-13-метил-4-этилгексен-212345671 2
- 8. 1) По углеродному скелетуCH2 = CH –
- 9. 3) Межклассовая изомерия CnH2n этиленовым изомерны циклоалканы.CH2
- 10. 4) пространственная CH3
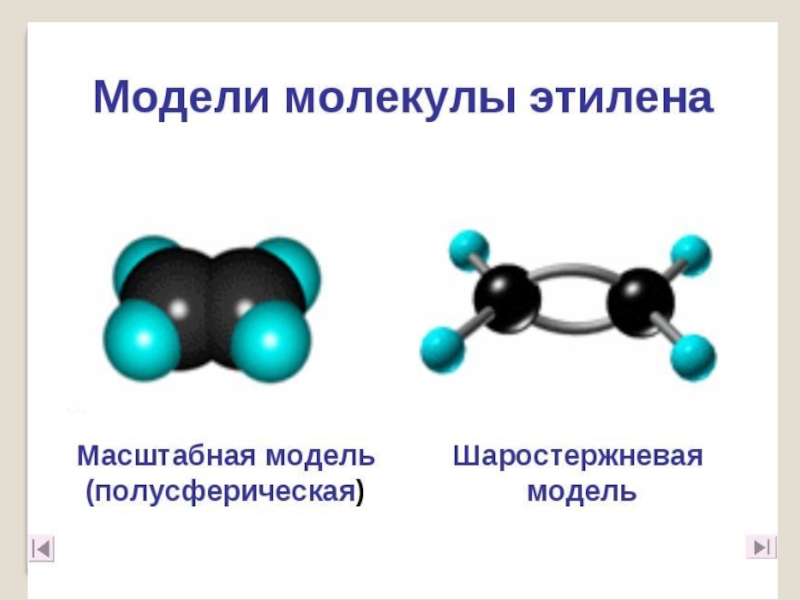
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Строение алкенов sp²- гибридизацияВалентный угол 120⁰Форма молекулы
- 15. π- связь менее прочна, чем
- 16. В связи с этим, π- связь легко
- 17. Получение алкенов 1) Дегидрирование алканов
- 18. Химические свойства алкенов 1. Для
- 19. б) Гидрирование. Легко присоединяют водород в
- 20. г) Гидратация. В присутствии минеральных кислот этиленовые присоединяют
- 21. 2. Алкены легко окисляются.
- 22. 3. Реакцией
- 23. Применение алкенов
Слайд 3 Алкены
Алкенами или олефинами, или этиленовыми углеводородами называются
Слайд 4Гомологический ряд этиленовых
Общая формула CnH2n
Суффикс ен, илен
1. -------
2.
3. Пропен пропилен
4. Бутен бутилен
5. Пентен амилен
6. Гексен гексилен
7. Гептен гептилен
С₂Н₄
С₃Н₆
С₄Н₈
С₅Н₁₀
С₆Н₁₂
С₇Н₁₄
Слайд 5Физические свойства.
Этиленовые углеводороды близки к алканам.
При нормальных условиях
C2
C5 – C17 –жидкости,
С₁₈ – твердые вещества.
Температура их плавления и кипения,
а также плотность увеличиваются с ростом
молекулярной массы.
Все олефины легче воды, плохо растворимы в ней, но растворимы в органических растворителях.
Слайд 6 Номенклатура
Название алкенов по систематической
номенклатуре образуют из
суффикс –ан меняем на –ен
Главная цепь атомов углерода должна
обязательно включать двойную связь,
и ее нумерацию атомов углерода проводят
с того конца, где ближе двойная связь.
В конце названия цифрой указывается номер
того атома углерода, от которого начинается
двойная связь.
Слайд 81) По углеродному скелету
CH2 = CH – CH2 – CH3
бутен-1 ׀
CH3
2-метилпропен-1
2) По положению двойной связи
CH2 = CH – CH2 – CH3 CH3 – CH = CH – CH3
бутен-1 бутен-2
Изомерия алкенов
Слайд 9
3) Межклассовая изомерия CnH2n
этиленовым изомерны циклоалканы.
CH2 = CH – CH2
бутен-1 | |
CH2 – CH2
циклобутан
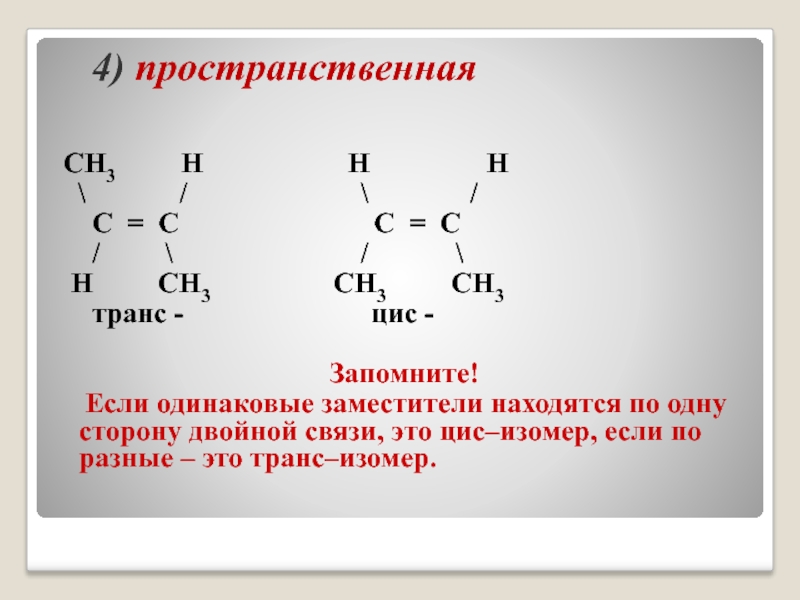
Слайд 10 4) пространственная
CH3
\ / \ /
C = C C = C
/ \ / \
H CH3 CH3 CH3
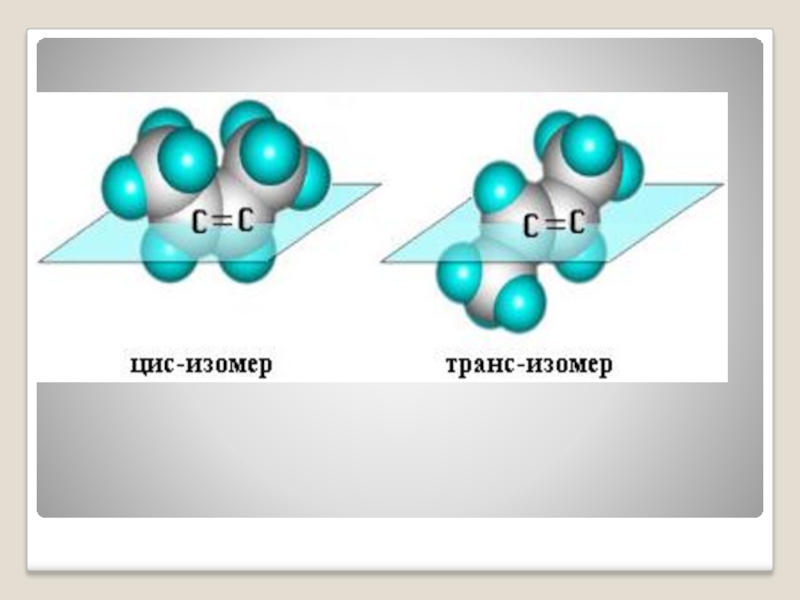
транс - цис -
Запомните!
Если одинаковые заместители находятся по одну сторону двойной связи, это цис–изомер, если по разные – это транс–изомер.
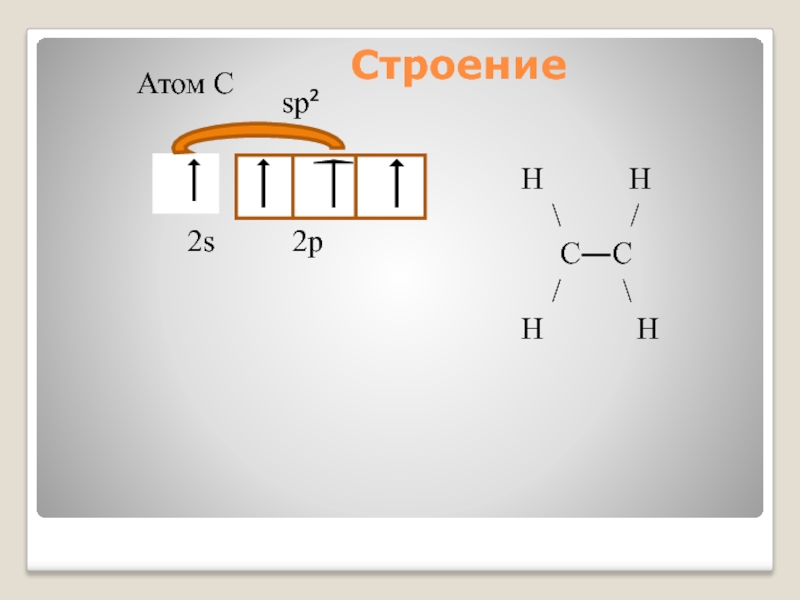
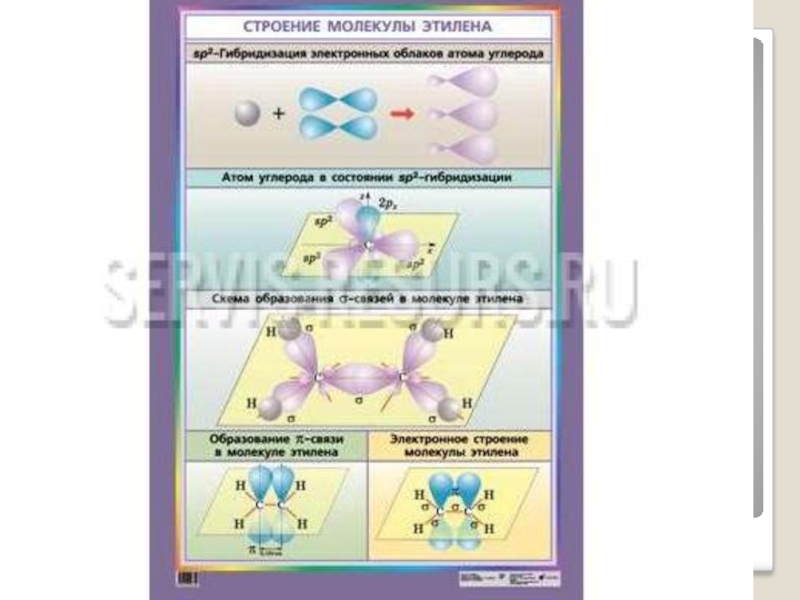
Слайд 14Строение алкенов
sp²- гибридизация
Валентный угол 120⁰
Форма молекулы плоская
При перекрывании гибридных орбиталей
При перекрывании р орбиталей, образуется π-связь.
Двойная связь алкенов представляет собой сочетание σ- и π- связей.
Длина связи C = C равна 0,134 нм
Слайд 15 π- связь менее прочна, чем σ- связь, так как
Слайд 16В связи с этим, π- связь легко разрывается и переходит в
Слайд 17
Получение алкенов
1) Дегидрирование алканов при повышенной температуре с катализатором.
пропан пропен
2) Дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная кислоты)
t CH3–CH2–OH → CH2=CH2 + H2O
Слайд 18Химические свойства алкенов
1. Для алкенов наиболее типичными являются
а) Галогенирование. Алкены при обычных условиях присоединяют галогены( по месту двойной связи).
H2C=CH2 + Br2 → BrCH2–CH2Br
Этилен 1,1-дибромэтан
обесцвечивание алкеном бромной воды является качественной реакцией на двойную связь.
Слайд 19 б) Гидрирование. Легко присоединяют водород в присутствии катализаторов (Pt, Pd,
CH3–CH=CH2 + H2 → CH3–CH2–CH3
пропен-1 пропан
в) Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды.
CH3–CH=CH2 + HBr → CH3–CH–CH3
l 2-метилпропан
Br
Слайд 20г) Гидратация. В присутствии минеральных кислот этиленовые присоединяют воду, образуя спирты.
CH3−CН=CH2 + H2O → CH3−CH−CH3
| пропанол-2
OH
Как видно, направление реакций гидратации определяется правилом Марковникова:
Водород присоединяется к наиболее гидрированному атому углерода по месту кратной связи.
Слайд 21 2. Алкены легко окисляются.
а) При сжигании
углекислый газ и воду.
H2C=CH2 + 3O2 → 2CO2 + 2H2O
б) При окислении алкенов разбавленным
раствором перманганата калия образуются
двухатомные спирты (реакция Е.Е.Вагнера).
3H2C=CH2 + 2KMnO4 + 4H2O → 2MnO2 +
2KOH + 3CH2−CH2 этиленгликоль
| |
OH OH
В результате реакции наблюдается обесцвечивание
раствора перманганата калия.
Слайд 22
3. Реакцией полимеризации называется процесс образования
n CH2 = CH2 → (- CH2 – CH2 -)n