Учитель химии Лукуша Елена Фёдоровна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии по теме
Содержание
- 1. Презентация по химии по теме
- 2. Академик С.И. Вольфковича вспоминал: “Фосфор получался в
- 3. периодФосфор как химический элементIIIгруппаVАвалентных электронов5степени окисления-3, +3, +5высший оксидР2О5 водородное соединениеРН3
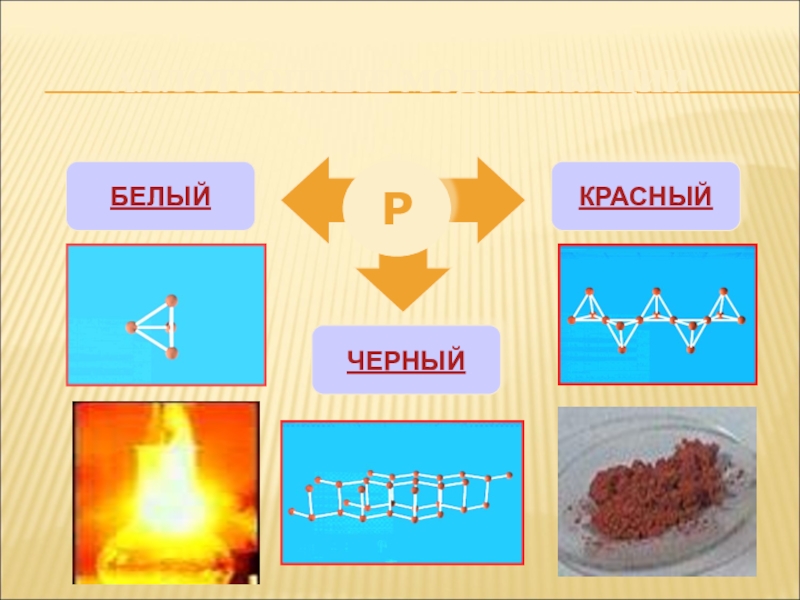
- 4. АЛЛОТРОПНЫЕ МОДИФИКАЦИИРБЕЛЫЙКРАСНЫЙЧЕРНЫЙ
- 5. Молекулы P4 имеют форму тетраэдра.
- 6. Слайд 6
- 7. Свечение белого фосфораhttp://school-collection.edu.ru/
- 8. Горение белого фосфора под водойhttp://school-collection.edu.ru/
- 9. Существует несколько форм красного фосфора
- 10. Слайд 10
- 11. Превращение красного фосфора в белый http://school-collection.edu.ru/
- 12. Сравнение температур воспламенения белого и красного фосфораhttp://school-collection.edu.ru/
- 13. Черный фосфор имеет слоистую атомную
- 14. Слайд 14
- 15. ХИМИЧЕСКИЕ СВОЙСТВА С металлами:
- 16. Горение фосфора в кислороде
- 17. Получение фосфида кальция
- 18. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
- 19. В промышленности фосфор получают из фосфоритов и
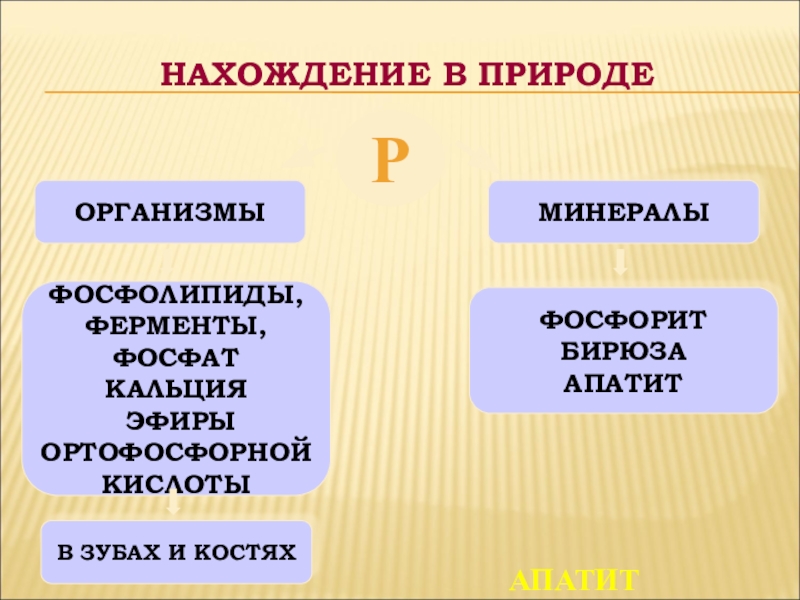
- 20. РОРГАНИЗМЫМИНЕРАЛЫФОСФОЛИПИДЫ,ФЕРМЕНТЫ,ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫВ ЗУБАХ И КОСТЯХФОСФОРИТБИРЮЗА АПАТИТНАХОЖДЕНИЕ В ПРИРОДЕАПАТИТ
- 21. НАХОЖДЕНИЕ ФОСФОРА В ПРИРОДЕ.В земной коре содержится
- 22. ФОСФОР В ОРГАНИЗМЕ ЧЕЛОВЕКА.Фосфор входит в состав
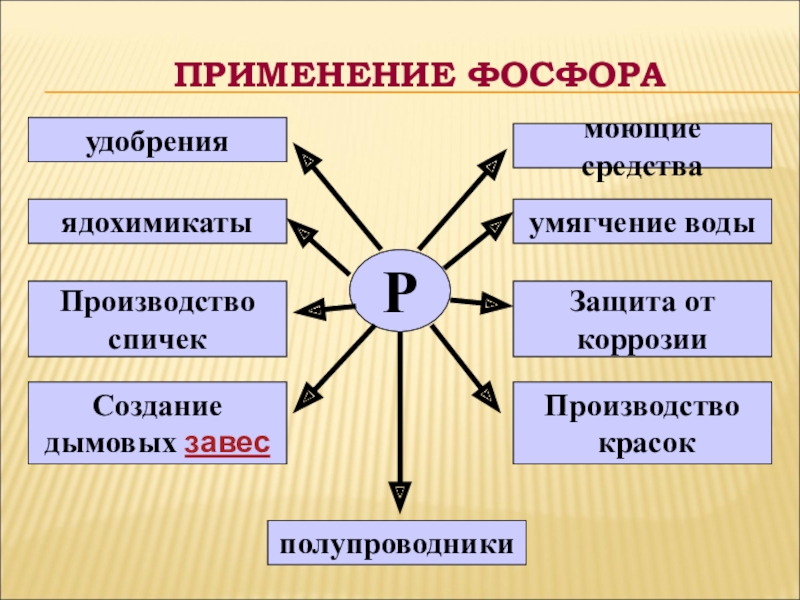
- 23. ПРИМЕНЕНИЕ ФОСФОРАРудобренияядохимикатыПроизводство спичекСоздание дымовых завесполупроводникиПроизводство красокЗащита от коррозииумягчение водымоющие средства
Академик С.И. Вольфковича вспоминал: “Фосфор получался в электрической печи, установленной в Московском университете на Моховой улице. Так как эти опыты проводились тогда в нашей стране впервые, я не предпринял тех предосторожностей, которые необходимы при работе с
Слайд 1Фосфор
М Б О У «Морская средняя общеобразовательная школа» городского округа
Судак Республики Крым
Слайд 2Академик С.И. Вольфковича вспоминал: “Фосфор получался в электрической печи, установленной в
Московском университете на Моховой улице. Так как эти опыты проводились тогда в нашей стране впервые, я не предпринял тех предосторожностей, которые необходимы при работе с газообразным фосфором – ядовитым, самовоспламеняющимся и светящимся голубоватым цветом элементом. В течение многих часов работы у электропечи часть выделяющегося газообразного фосфора настолько пропитала мою одежду и даже ботинки, что когда ночью я шел из университета по темным, не освещенным тогда улицам Москвы, моя одежда излучала голубоватое сияние, а из-под ботинок (при трении их о тротуар) высекались искры. За мной каждый раз собиралась толпа, среди которой, несмотря на мои объяснения, немало было лиц, видевших во мне “новоявленного” представителя потустороннего мира. Вскоре среди жителей района Моховой и по всей Москве из уст в уста стали передаваться фантастические рассказы о “светящемся монахе”...
Слайд 3период
Фосфор как химический элемент
III
группа
VА
валентных электронов
5
степени окисления
-3, +3, +5
высший оксид
Р2О5
водородное соединение
РН3
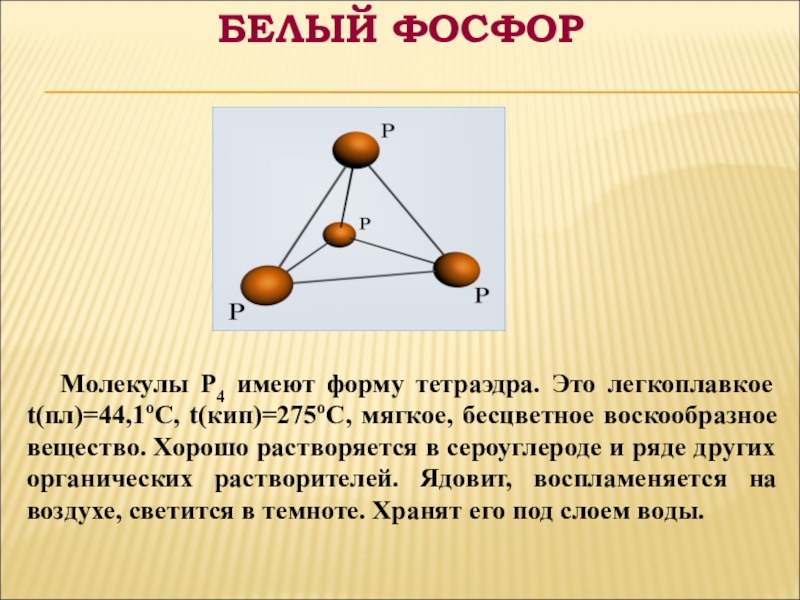
Слайд 5 Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС,
мягкое, бесцветное воскообразное вещество. Хорошо растворяется в сероуглероде и ряде других органических растворителей. Ядовит, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды.
БЕЛЫЙ ФОСФОР
Слайд 9
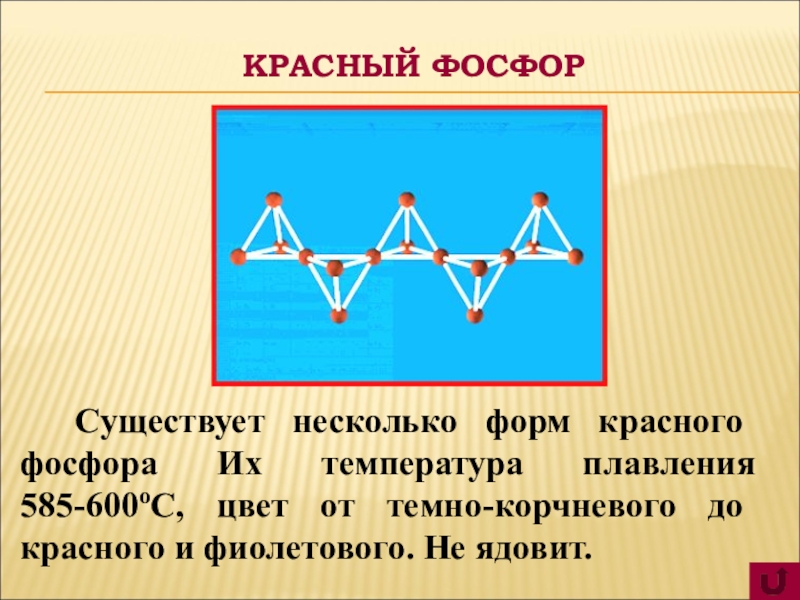
Существует несколько форм красного фосфора Их температура плавления 585-600оС,
цвет от темно-корчневого до красного и фиолетового. Не ядовит.
КРАСНЫЙ ФОСФОР
Слайд 12Сравнение температур воспламенения белого и красного фосфора
http://school-collection.edu.ru/
Слайд 13
Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему
виду похож на графит, но является полупроводником. Не ядовит.
ЧЕРНЫЙ ФОСФОР
Слайд 19В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в
электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля.
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Слайд 20
Р
ОРГАНИЗМЫ
МИНЕРАЛЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ
ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
В ЗУБАХ И КОСТЯХ
ФОСФОРИТ
БИРЮЗА
АПАТИТ
НАХОЖДЕНИЕ В ПРИРОДЕ
АПАТИТ
Слайд 21НАХОЖДЕНИЕ ФОСФОРА В ПРИРОДЕ.
В земной коре содержится около 0,08%
фосфора. В
природе фосфор содержится
в виде соединений – минералов
(апатиты и фосфориты).
в виде соединений – минералов
(апатиты и фосфориты).
Слайд 22ФОСФОР В ОРГАНИЗМЕ ЧЕЛОВЕКА.
Фосфор входит в состав белковых веществ в виде
различных соединений. Содержание фосфора в тканях мозга составляет 0,38%, мышцах — 0,27%.