- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Основные сведения о строении атомов. Изотопы
Содержание
- 1. Презентация по химии Основные сведения о строении атомов. Изотопы
- 2. Слайд 2
- 3. Атомгреч. atomos«неделимый»
- 4. Слайд 4
- 5. Антуан Анри БеккерельАнтуан Анри БеккерельОткрывает явление самопроизвольного деления атома, которое было названо радиоактивностью.
- 6. Жан Батист ПерренВ 1901 г. физик предложил первую модель строения атома.
- 7. Эрнест РезерфордВ 1911 г. предложил уточнённую «планетарную» модель строения атома.
- 8. Эрнест РезерфордВ 1913 г. доказал, что порядковый
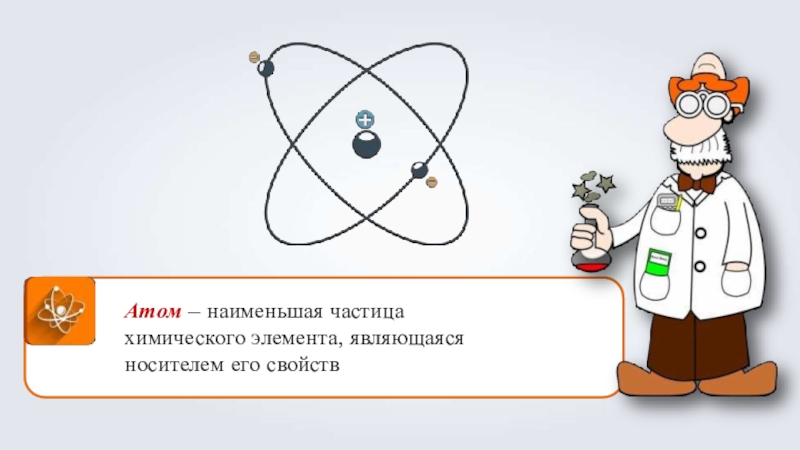
- 9. Атом – наименьшая частица химического элемента, являющаяся носителем его свойств
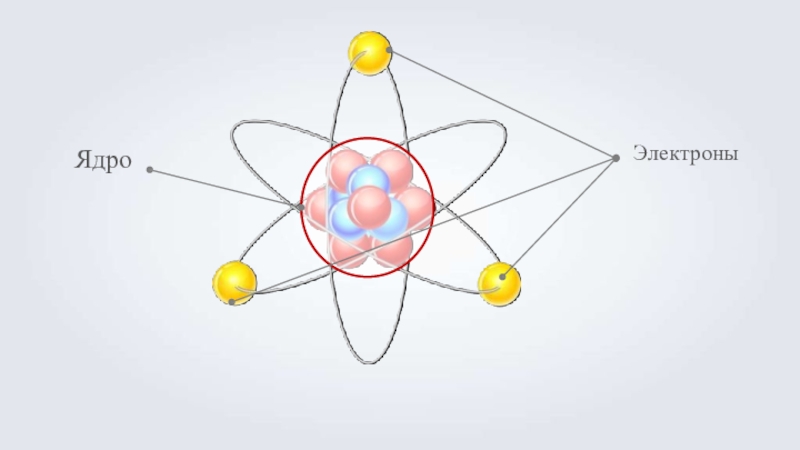
- 10. ЯдроЭлектроны
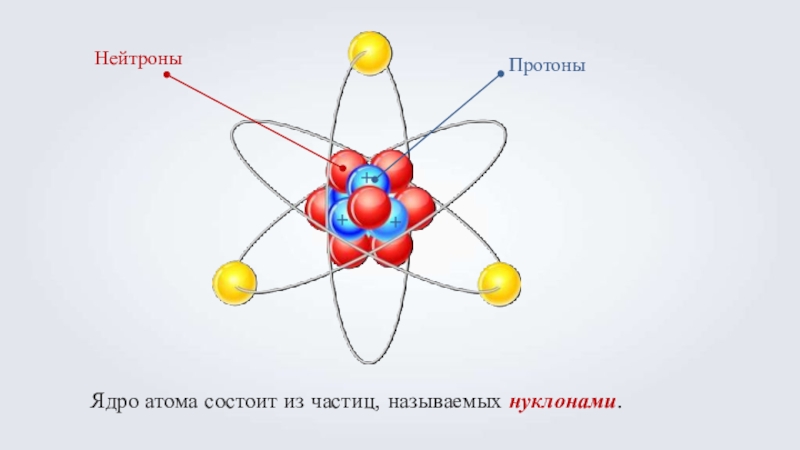
- 11. Ядро атома состоит из частиц, называемых нуклонами.Протоны+++Нейтроны
- 12. Протоныp+
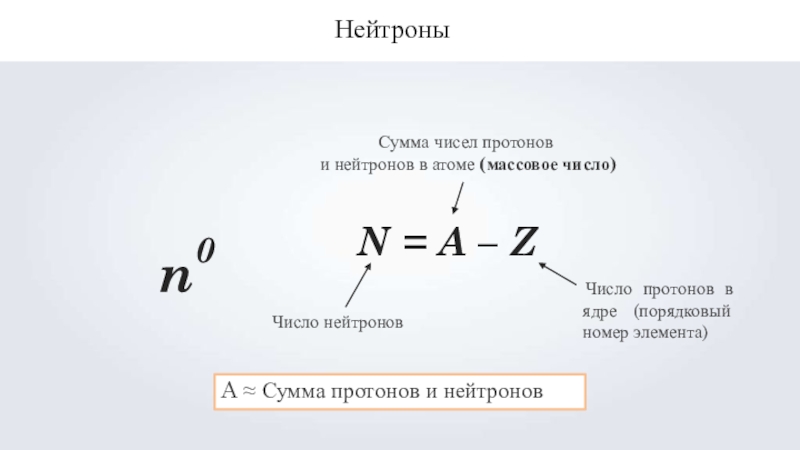
- 13. Нейтроныn0N = A – ZЧисло нейтроновСумма чисел
- 14. НейтроныНайдём число нейтронов в ядре калия.N =
- 15. НейтроныНайдём число нейтронов в ядре аргона.N =
- 16. Электроные-Число электронов равно числу протонов.
- 17. ЭлектроныНайдем из периодической системы число электронов и протонов брома.Число электронов = 35 Z = 35
- 18. ЭлектроныНайдем из периодической системы число электронов и протонов серы.Число электронов = 16 Z = 16
- 19. ЭлектроныНайдем из периодической системы число электронов и протонов никеля.Число электронов = 28 Z = 28
- 20. Слайд 20
- 21. Разные атомы одного и того же химического элемента различаются по массам.
- 22. A = 1 A = 2A = 3Заряд ядра = +1 (1 электрон + 1 протон)
- 23. Изотопы — разновидности атомов одного и того же химического элемента, имеющие разные массы
- 24. Если число протонов в ядре совпадает с
- 25. Слайд 25
- 26. Нанотехнологии
Атомгреч. atomos«неделимый»
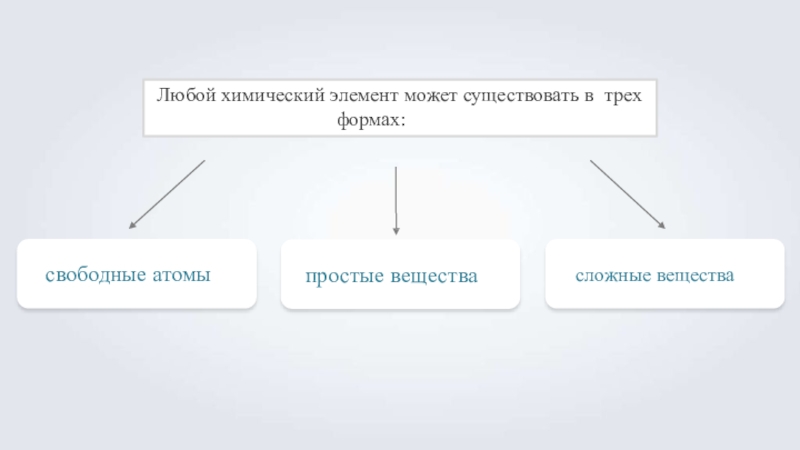
Слайд 1Любой химический элемент может существовать в трех формах:
свободные атомы
простые вещества
сложные вещества
Слайд 5
Антуан Анри Беккерель
Антуан Анри Беккерель
Открывает явление самопроизвольного деления атома, которое было
названо радиоактивностью.
Слайд 8Эрнест Резерфорд
В 1913 г. доказал, что порядковый (атомный) номер химического элемента
численно равен заряду ядра его атома.
Химический элемент – это вид атомов с одинаковым зарядом ядра
Слайд 13Нейтроны
n0
N = A – Z
Число нейтронов
Сумма чисел протонов
и нейтронов в атоме
(массовое число)
Число протонов в ядре (порядковый номер элемента)
A ≈ Сумма протонов и нейтронов
Слайд 17Электроны
Найдем из периодической системы число электронов и протонов брома.
Число электронов =
35 Z = 35
Слайд 18Электроны
Найдем из периодической системы число электронов и протонов серы.
Число электронов =
16 Z = 16
Слайд 19Электроны
Найдем из периодической системы число электронов и протонов никеля.
Число электронов =
28 Z = 28
Слайд 24Если число протонов в ядре совпадает с числом
электронов, то атом электрически
нейтрален.
Если же число электронов больше или меньше числа протонов, то атом приобретает отрицательный, либо положительный заряд соответственно и становится ионом.