- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Окислительно-восстановительные реакции
Содержание
- 1. Презентация по химии Окислительно-восстановительные реакции
- 2. Генетический ряд кальцияCa CaO
- 3. Химические реакцииРеакции, протекающие без изменения степени окисленияNa+O-2H+
- 4. Степень окисления – условный заряд
- 5. Расчет степени окисления Следует запомнить:1. Степени окисления
- 6. Расчет степени окисления1. Для веществ из двух
- 7. Расчет степени окисления2. Для веществ из трех
- 8. Окислительно-восстановительные реакции Реакции, протекающие с изменением
- 9. Окислитель - частица (атом, ион), которая
- 10. Восстановитель - частица (атом, ион), которая
- 11. Сочиняют дети… Окислитель, как отъявленный злодей,
- 12. Восстановитель – это тот, Кто электроны отдает. Сам отдает грабителю, Злодею – окислителю!
- 13. Слайд 13
- 14. Окисление-восстановление Окислением называется процесс отдачи атомом,
- 15. Окисление-процесс отдачи электронов H20 - 2ē
- 16. Восстановление –процесс присоединения электроновMn+4 + 2ē
- 17. Выполните задание: Расставьте СО. Определите какие
- 18. Домашнее задание:§ 43 (стр. 229-231);задание 1.
- 19. Окислительно-восстановительные реакцииМетод электронного баланса
- 20. 2H⁺Cl¯ + Zn⁰
Генетический ряд кальцияCa CaO Ca(OH)₂ Ca₃(PO₄)₂2Са⁰ + О₂⁰ = 2Са⁺²О¯²Са⁺²О¯² + Н₂⁺О¯² = Са⁺²(O¯²H⁺)₂….
Слайд 2Генетический ряд кальция
Ca CaO Ca(OH)₂
Ca₃(PO₄)₂
2Са⁰ + О₂⁰ = 2Са⁺²О¯²
Са⁺²О¯² + Н₂⁺О¯² = Са⁺²(O¯²H⁺)₂
….
2Са⁰ + О₂⁰ = 2Са⁺²О¯²
Са⁺²О¯² + Н₂⁺О¯² = Са⁺²(O¯²H⁺)₂
….
Слайд 3Химические реакции
Реакции, протекающие без изменения степени окисления
Na+O-2H+ + H+N+5O-23 = Na+N+5O-23 + H+2O-2
2) Реакции,
протекающие с изменением степени окисления
2Mg0 + O20 = 2Mg+2O-2
2Mg0 + O20 = 2Mg+2O-2
Слайд 4 Степень окисления – условный заряд атомов химического элемента в
соединении, рассчитанный исходя из условия, что все соединения состоят только из ионов.
Слайд 5Расчет степени окисления
Следует запомнить:
1. Степени окисления атомов в простых веществах равны
нулю: Na0; H20
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю.
3. Постоянную степень окисления в сложных веществах имеют атомы:
-щелочных металлов (+1) K+1CI, Li+1NO3
-щелочноземельных металлов (+2) Ca+2CO3
-водорода (+1) H2+1SO4
-кислорода (-2) H2O-2
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю.
3. Постоянную степень окисления в сложных веществах имеют атомы:
-щелочных металлов (+1) K+1CI, Li+1NO3
-щелочноземельных металлов (+2) Ca+2CO3
-водорода (+1) H2+1SO4
-кислорода (-2) H2O-2
Слайд 6Расчет степени окисления
1. Для веществ из двух элементов:
-поставить постоянную степень окисления
CO-2
-рассчитать степень окисления другого элемента:
сумма степеней окисления должна быть равна 0,
поэтому степень окисления атома C также будет равна 2,
но иметь противоположный знак, т.е. +
-поставить вторую степень окисления C+2O-2
-выполнить упражнения:
определить степени окисления элементов в следующих веществах
NaCI; CaBr2; MgO; H2S
-рассчитать степень окисления другого элемента:
сумма степеней окисления должна быть равна 0,
поэтому степень окисления атома C также будет равна 2,
но иметь противоположный знак, т.е. +
-поставить вторую степень окисления C+2O-2
-выполнить упражнения:
определить степени окисления элементов в следующих веществах
NaCI; CaBr2; MgO; H2S
Слайд 7Расчет степени окисления
2. Для веществ из трех и более элементов:
-поставить постоянные
степени окисления H+1MnO4-2
-рассчитать степень окисления марганца
сумма положительных степеней окисления равна 1
сумма отрицательных степеней окисления равна 8
так как эти суммы должны быть равны, то на атом марганца приходится 7 положительных СО
-поставить рассчитанную степень окисления H+1Mn+7O4-2
-выполнить упражнения:
определить степени окисления элементов в следующих веществах
H2MnO4, H2SO4, HNO3, KCIO3
-рассчитать степень окисления марганца
сумма положительных степеней окисления равна 1
сумма отрицательных степеней окисления равна 8
так как эти суммы должны быть равны, то на атом марганца приходится 7 положительных СО
-поставить рассчитанную степень окисления H+1Mn+7O4-2
-выполнить упражнения:
определить степени окисления элементов в следующих веществах
H2MnO4, H2SO4, HNO3, KCIO3
Слайд 8Окислительно-восстановительные реакции
Реакции, протекающие с изменением степени окисления, называются окислительно-восстановительными
реакциями.
Mn+4O2 + 4HCl-1 = Mn+2Cl2 + Cl20 + 2H2O
Mn+4O2 + 4HCl-1 = Mn+2Cl2 + Cl20 + 2H2O
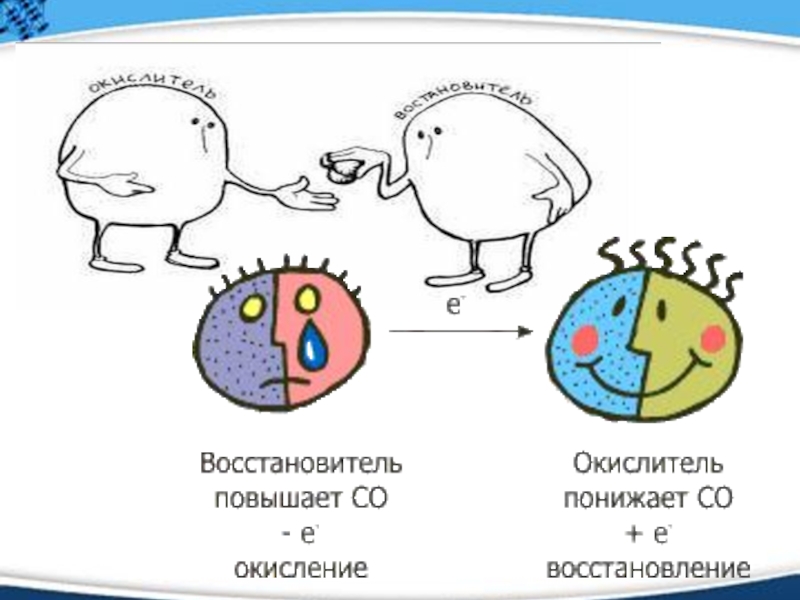
Слайд 9Окислитель
- частица (атом, ион), которая в ходе окислительно-восстановительного процесса
принимает электроны
Типичные окислители
К ним относятся многие
сложные и простые вещества
KClO3, F2,
H2SO4 (конц.), Cl2,
HNO3, O2,
KMnO4,
MnO2,
K2Cr2O7,
PbO2 и др.
Типичные окислители
К ним относятся многие
сложные и простые вещества
KClO3, F2,
H2SO4 (конц.), Cl2,
HNO3, O2,
KMnO4,
MnO2,
K2Cr2O7,
PbO2 и др.
Слайд 10Восстановитель
- частица (атом, ион), которая в ходе окислительно-восстановительного процесса
отдает электроны
Типичные восстановители
К ним также относятся
простые и сложные вещества
H2, KI,
C (графит), HCl (конц.),
Zn, H2S,
Al, CO и др.
Ca и др.
Типичные восстановители
К ним также относятся
простые и сложные вещества
H2, KI,
C (графит), HCl (конц.),
Zn, H2S,
Al, CO и др.
Ca и др.
Слайд 11Сочиняют дети…
Окислитель, как отъявленный злодей,
Как пират, бандит, агрессор,
Бармалей,
Отнимает электроны - и OK!
Потерпев урон, восстановитель
Восклицает: "Вот я! Помогите!
Электроны мне мои верните!"
Но никто ему не помогает
И тем более ущерб не возмещает.
Слайд 14Окисление-восстановление
Окислением называется процесс отдачи атомом, молекулой или ионом электронов.
Степень окисления при этом повышается.
Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается.
Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается.
окисление
восстановление
Слайд 15Окисление-процесс отдачи электронов
H20 - 2ē
2H+
восстановитель
S-2 - 2ē = S0
Al0 - 3ē = Al+3
Fe+2 - ē = Fe+3
2Br - - 2ē = Br20
При окислении степень окисления
элемента повышается, а элемент является
восстановителем.
восстановитель
S-2 - 2ē = S0
Al0 - 3ē = Al+3
Fe+2 - ē = Fe+3
2Br - - 2ē = Br20
При окислении степень окисления
элемента повышается, а элемент является
восстановителем.
процесс
окисления
Слайд 16Восстановление –процесс присоединения электронов
Mn+4 + 2ē
Mn+2
окислитель
S0 + 2ē = S-2
Cr+6 +3ē = Cr+3
Cl20 +2ē = 2Cl-
O20 + 4ē = 2O-2
При восстановлении степень окисления
элемента понижается, а элемент является
окислителем.
окислитель
S0 + 2ē = S-2
Cr+6 +3ē = Cr+3
Cl20 +2ē = 2Cl-
O20 + 4ē = 2O-2
При восстановлении степень окисления
элемента понижается, а элемент является
окислителем.
процесс
восстановления
Слайд 17Выполните задание:
Расставьте СО. Определите какие реакции относятся к ОВР.
Укажите окислитель и восстановитель, окислительный и восстановительный процессы.
2 KOH + H2SO4 = K2SO4 + 2 H2O,
2 Al + Fe2O3 = Al2O3 + 2 Fe,
C + 4 HNO3 = CO2 + 4 NO2+ 2 H2O,
MgCO3 = MgO + CO2,
Mg + 2HCl = MgCl2 + H2,
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl,
2Fe + 3Cl2 = 2FeCl3
2 KOH + H2SO4 = K2SO4 + 2 H2O,
2 Al + Fe2O3 = Al2O3 + 2 Fe,
C + 4 HNO3 = CO2 + 4 NO2+ 2 H2O,
MgCO3 = MgO + CO2,
Mg + 2HCl = MgCl2 + H2,
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl,
2Fe + 3Cl2 = 2FeCl3
Слайд 202H⁺Cl¯ + Zn⁰ Zn⁺²Cl¯
+ H₂⁰
Записываем степени окисления элементов
Определяем окислитель и восстановитель
Записываем электронные уравнения:
2H⁺ + 2ẽ H₂⁰
Окислитель
Zn⁰ - 2ẽ Zn⁺²
Восстановитель
Записываем степени окисления элементов
Определяем окислитель и восстановитель
Записываем электронные уравнения:
2H⁺ + 2ẽ H₂⁰
Окислитель
Zn⁰ - 2ẽ Zn⁺²
Восстановитель
процесс
восстановления
процесс
окисления