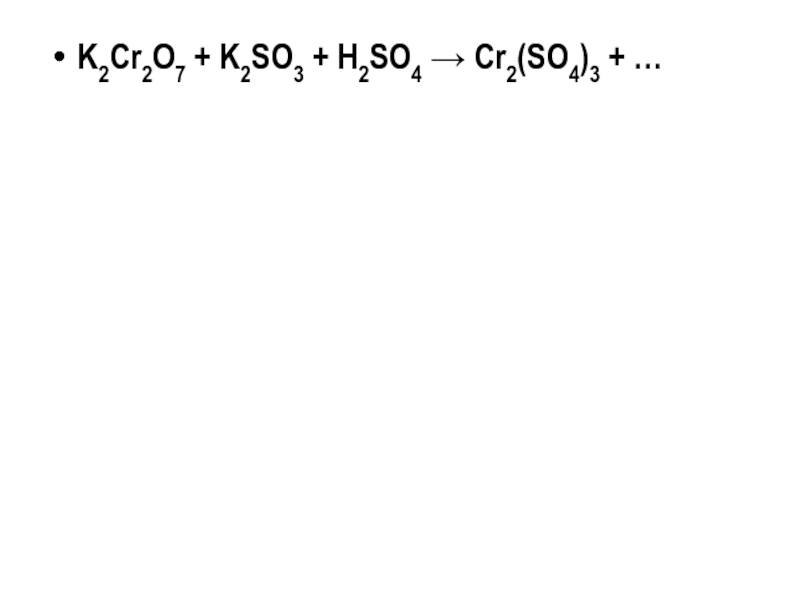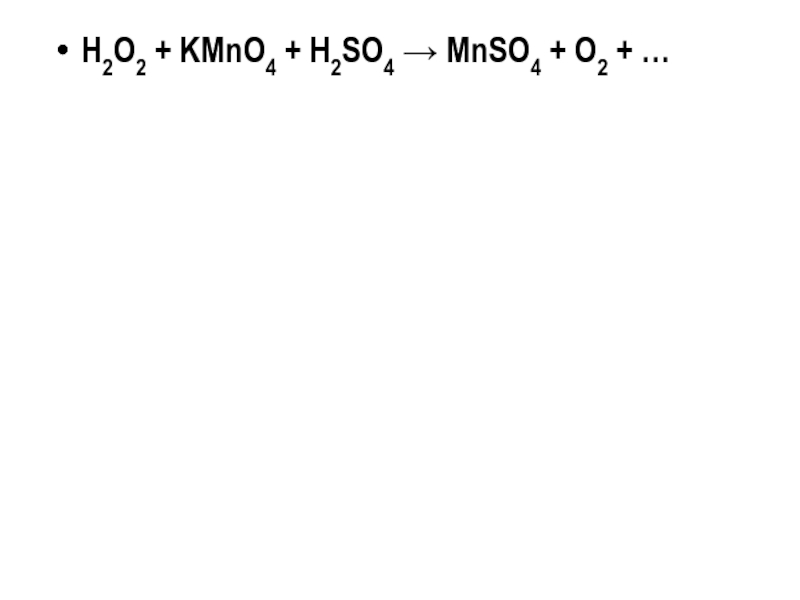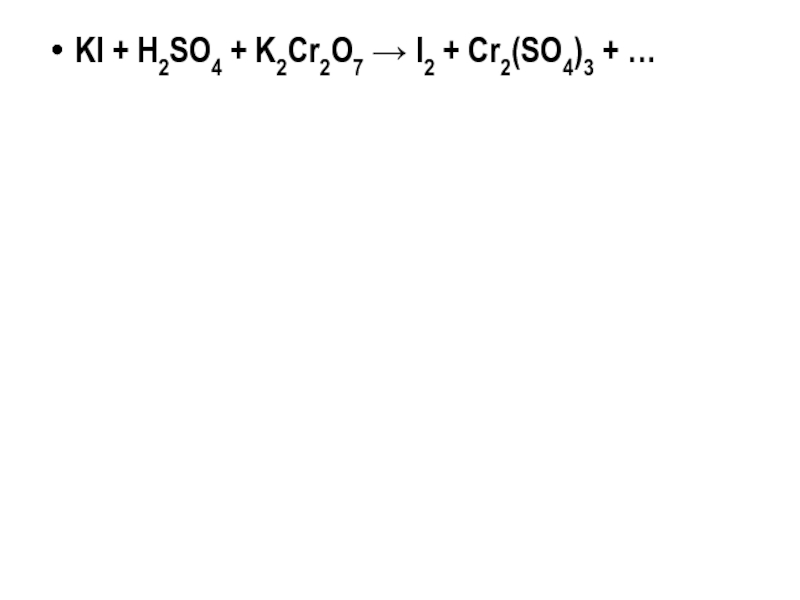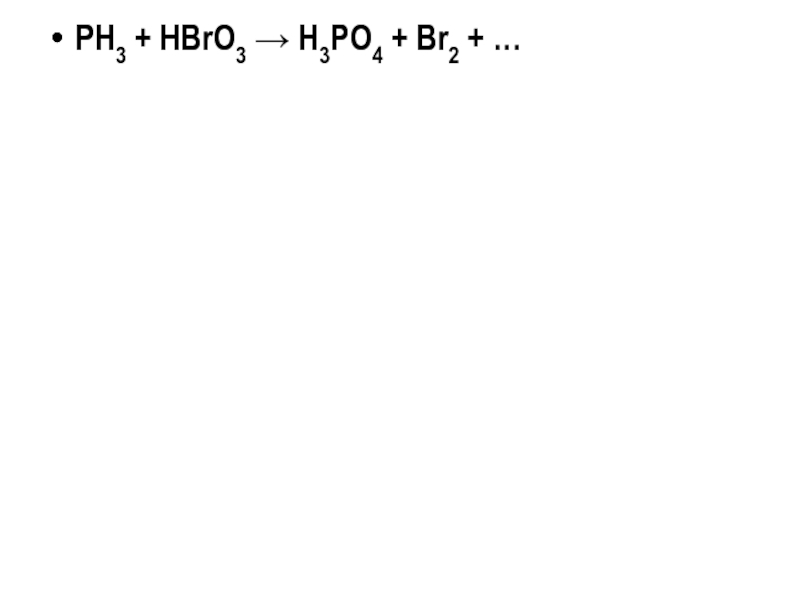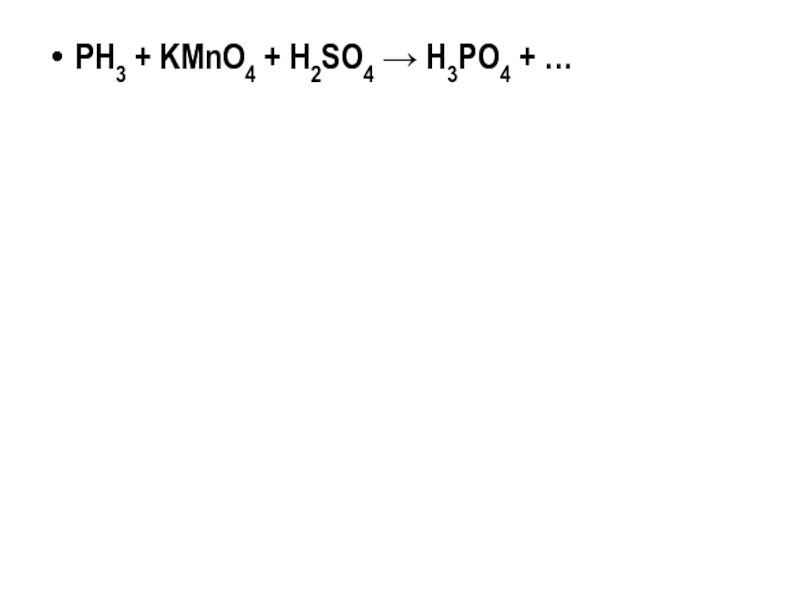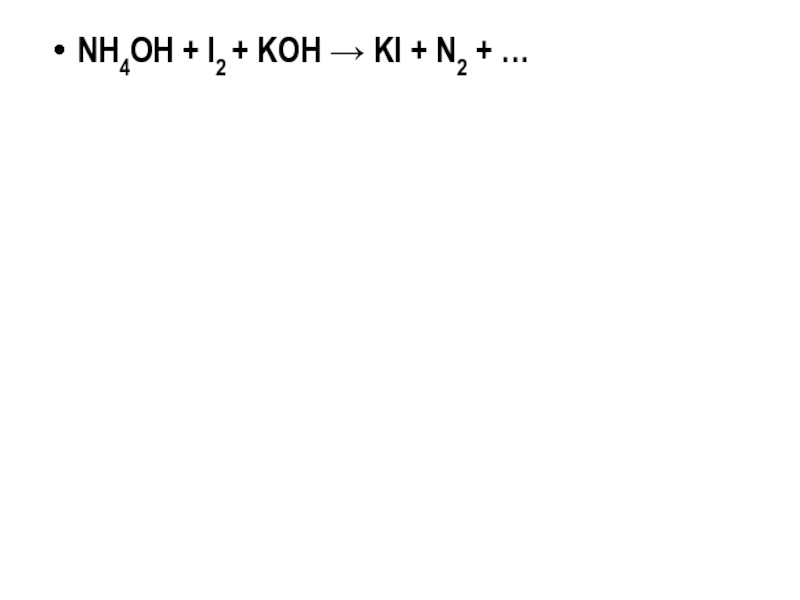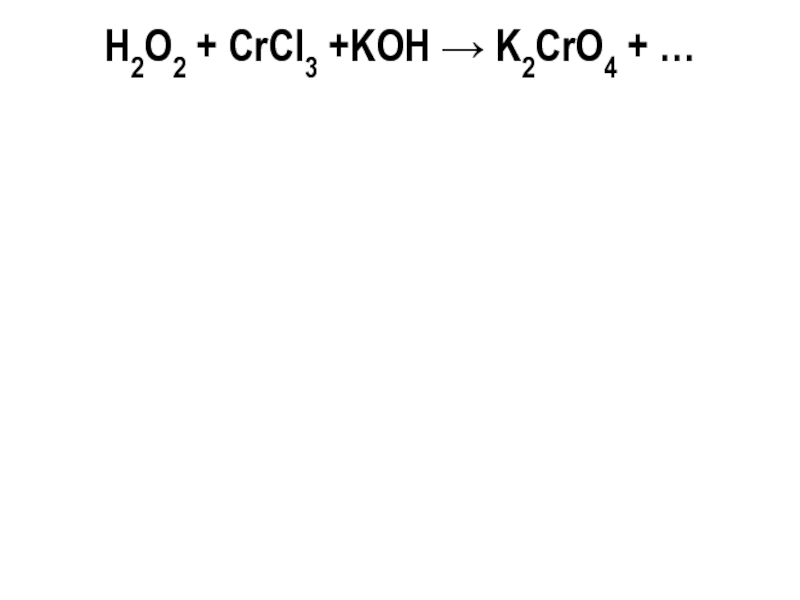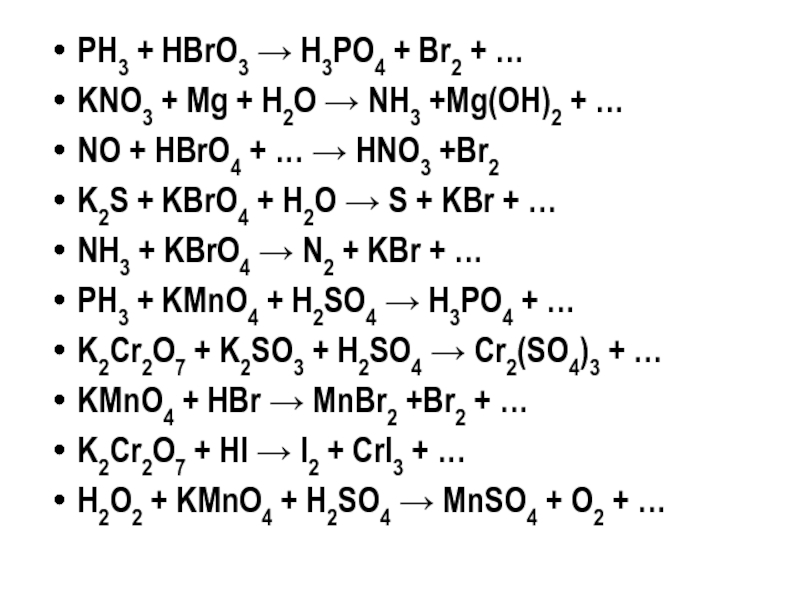- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Окислительно-восстановительные реакции (11 класс, углубление)
Содержание
- 1. Презентация по химии Окислительно-восстановительные реакции (11 класс, углубление)
- 2. ОкислителиАтомы, молекулы и ионы, присоединяющие электроны. Во
- 3. Окислители Галогены (F2,Cl2,Br2,I2) – Cl2
- 4. ВосстановителиАтомы, молекулы и ионы, отдающие электроны. Во
- 5. Восстановители Металлы – в кислой среде окисляются
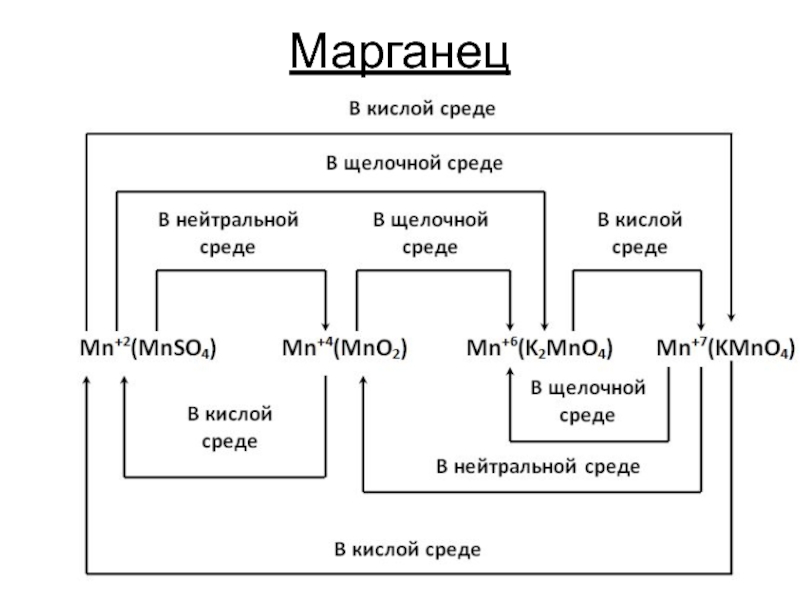
- 6. Марганец
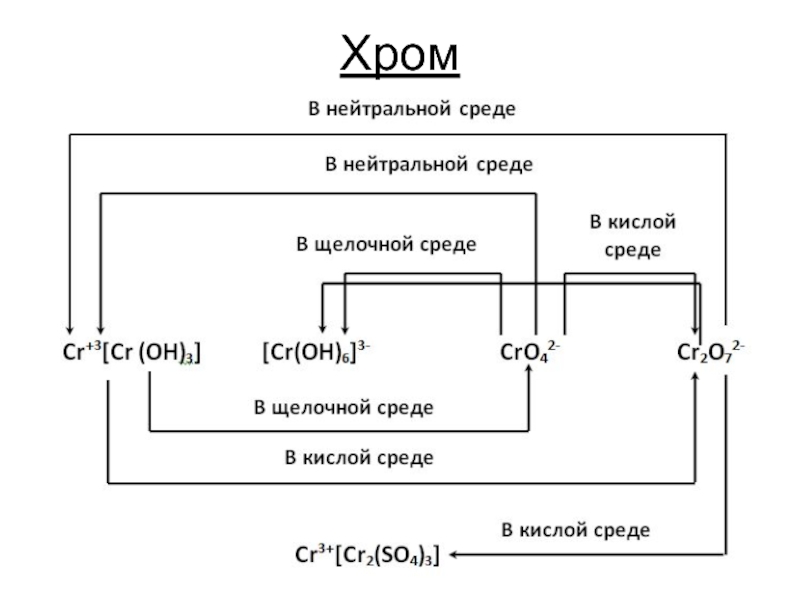
- 7. Хром
- 8. Пероксид водорода
- 9. Особые случаи расстановки коэффициентов методом электронного балансаЕсли
- 10. Если в сложном веществе атомы одного элемента
- 11. Если в уравнении два восстановителя или два
- 12. Если в соединении элемент имеет дробную степень окисления: Mn3O4+KClO3+K2CO3→K2MnO4+KCl+ +CO2
- 13. Общие положения ионно-электронного метода Общее правило:
- 14. Кислая среда: избыток атомов кислорода связывается ионами
- 15. Самостоятельная работаK2Cr2O7 + K2SO3 + H2SO4 →
- 16. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + …
- 17. H2O2 + KMnO4 + H2SO4 → MnSO4 + O2 + …
- 18. KI + H2SO4 + K2Cr2O7 → I2 + Cr2(SO4)3 + …
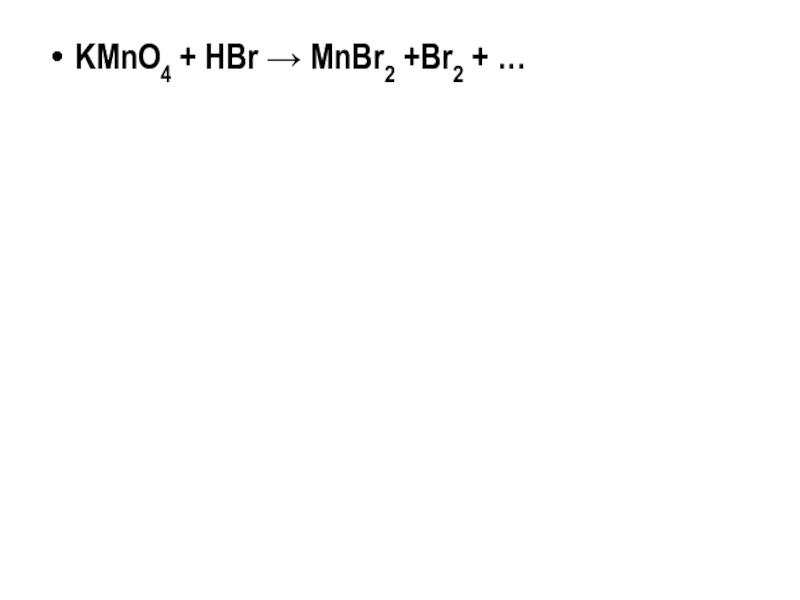
- 19. KMnO4 + HBr → MnBr2 +Br2 + …
- 20. PH3 + НBrO3 → H3PO4 + Br2 + …
- 21. PH3 + KMnO4 + H2SO4 → H3PO4 + …
- 22. Щелочная среда: недостаток атомов кислорода возмещаем гидроксид
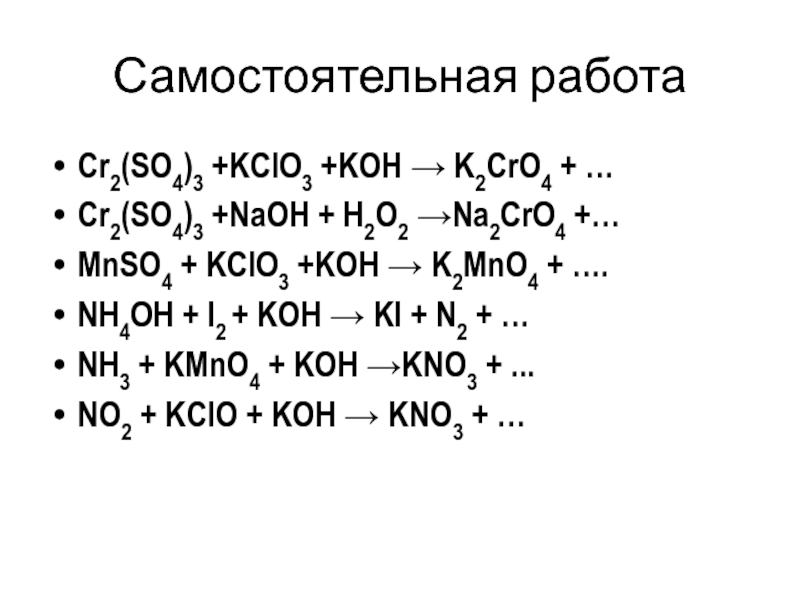
- 23. Самостоятельная работаCr2(SO4)3 +KClO3 +KOH → K2CrO4 +
- 24. Cr2(SO4)3 +KClO3 +KOH → K2CrO4 + …
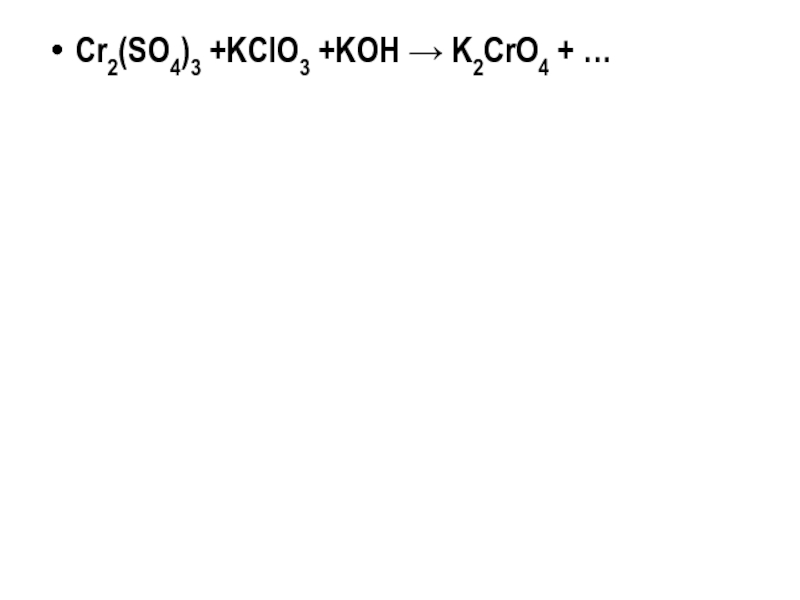
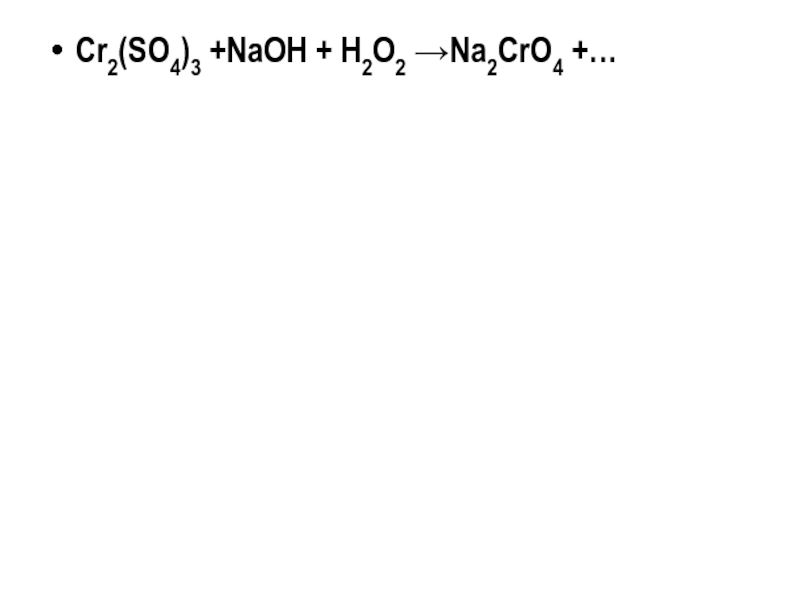
- 25. Cr2(SO4)3 +NaOH + H2O2 →Na2CrO4 +…
- 26. MnSO4 + KClO3 +KOH → K2MnO4 + ….
- 27. NH4OH + I2 + KOH → KI + N2 + …
- 28. NH3 + KMnO4 + KOH →KNO3 + ...
- 29. NO2 + KClO + KOH → KNO3 + …
- 30. Нейтральная среда: в левой части всегда пишем
- 31. Самостоятельная работаK2S + KBrO4 +H2O → S
- 32. Mn(NO3)2 + HNO3 +PbO2 →HMnO4 + Pb(NO3)2 +…2Mn(NO3)2+6HNO3 +5PbO2→2HMnO4+5Pb(NO3)2 +2H2O
- 33. H2O2 + CrCl3 +KOH → K2CrO4 + …
- 34. Fe(OH)2 + NaBrO + H2O → …
- 35. PH3 + НBrO3 → H3PO4 + Br2
- 36. FeCl2 + HCl + K2Cr2O7 → FeCl3
- 37. P2O3 + H2Cr2O7 + … → H3PO4
- 38. Окисление алкенов (кислая среда)В результате разрыва двойной
- 39. Окисление алкенов (кислая среда)В результате разрыва двойной
- 40. Окисление алкенов (кислая среда)В результате разрыва двойной
- 41. Окисление алкенов (кислородом)
- 42. Окисление алкинов (кислая среда)CH3–C≡C–СН2 –CH3+KMnO4+H2SO4→СН3СООН+С2Н5СООН
- 43. Окисление алкинов (нейтральная среда)CН≡CH+KMnO4→КООС – СООК+MnO2+KOH +
- 44. Окисление алкинов (нейтральная среда)СН3 – C≡CH+H2O+KMnO4→СН3СООK+КНСО3 +MnO2+KOH
- 45. Окисление алкинов (щелочная среда)CH3–C≡CH+KMnO4+KOH→СН3СООК+К2СО3 +K2MnO4+ H2O
- 46. Окисление аренов (кислая среда)С6H5 – CH3 +KMnO4+H2SO4→С6Н5СООН+MnSO4
- 47. Окисление аренов (кислая среда)С6H5СН2 – CH3 +KMnO4+H2SO4→С6Н5СООН
- 48. Окисление аренов (щелочная среда)С6H5 – CH3 +KMnO4+KOH→С6Н5СООК
- 49. Окисление аренов (щелочная среда)С6H5СН2–CH3+KMnO4+KOH→С6Н5СООК +К2СО3+K2MnO4+H2O
- 50. Окисление аренов (нейтральная среда)С6H5 – CH3 +KMnO4→С6Н5СООK+MnO2+KOH
- 51. Окисление аренов (нейтральная среда)С6H5СН2 – CH3+KMnO4→С6Н5СООK+ К2СО3+
- 52. Окисление аренов С6H5СН =CH2+10KMnO4+13KOH→С6Н5СООК +К2СО3+
- 53. Окисление аренов 5
- 54. Окисление спиртов
- 55. Окисление альдегидов
- 56. Слайд 56
- 57. Окисление
- 58. Часть В тест (ОВР)
- 59. 5PH3 + 8НBrO3 →5 H3PO4 + 4Br2
- 60. 6FeCl2+14HCl+K2Cr2O7→6FeCl3+2CrCl3+2KCl+ 7H2O2KMnO4+8H2SO4+10KI→2MnSO4+5I2+6K2SO4+8H2O5Na2SO3+2KMnO4+3H2SO4→5Na2SO4+2MnSO4+K2SO4+ +3H2O6KI+7H2SO4+K2Cr2O7→3I2+Cr2(SO4)3+4K2SO4+7 H2O3H2S + H2O +
- 61. 3P2O3+2H2Cr2O7 + H2O → 2H3PO4 + 4CrPO43Na2SO3
Слайд 2Окислители
Атомы, молекулы и ионы, присоединяющие электроны. Во время реакции они восстанавливаются.
Cl20 + 2e → 2Cl-1
Fe+3 + e → Fe+2
Степень окисления понижается
Слайд 3Окислители
Галогены (F2,Cl2,Br2,I2) – Cl2 + 2e ↔ 2Cl-1
Кислородсодержащие кислоты
кислородсодержащие кислоты галогенов и их соли) HClO, HClO3, HBrO3, HIO3 – восстанавливаются до СО галогена -1 (если Cl и Br ) или 0 (если I)
Ионы металла в высшей степени окисления ( Fe3+, Cu2+, Hg2+) - Fe+3 + е → Fe+2
Слайд 4Восстановители
Атомы, молекулы и ионы, отдающие электроны. Во время реакции они окисляются.
H20 – 2e → 2H+1
2Cl-1 – 2e → Cl20
Степень окисления повышается
Слайд 5Восстановители
Металлы – в кислой среде окисляются до Ме+n;
в щелочной
Неметаллы (H2,C, P, Si) - C до СО или СО2, Р до Н3РО4
HCl, HBr, HI, H2S – до Cl2, Br2, I2,S
Металлы Fe2+, Cu+, Hg+ - повышают СО
HNO2 и нитриты окисляются до HNO3 и её солей
Слайд 9Особые случаи расстановки коэффициентов методом электронного баланса
Если у элемента, являющегося окислителем
2Cr+6
Слайд 10Если в сложном веществе атомы одного элемента соединены между собой непосредственно,
H2S2 + O2 → H2O + SO2
C4H8 + O2 → H2O + CO2
Слайд 11Если в уравнении два восстановителя или два окислителя входят в состав
Fe(NO3)2 → Fe2O3 + NO2 + O2
As2S3+HNO3→H3AsO4+SO2+NO2+H2O
Cu2S + O2 → CuO + SO2
Слайд 12Если в соединении элемент имеет дробную степень окисления:
Mn3O4+KClO3+K2CO3→K2MnO4+KCl+ +CO2
Слайд 13Общие положения ионно-электронного метода
Общее правило: сильные электролиты записываются в
Слайд 14Кислая среда: избыток атомов кислорода связывается ионами водорода, добавляем удвоенное их
H2S + K2Cr2O7 + H2SO4 → S + …
Cr2O72- +14H+ +6e → 2Cr3+ +7H2O 1 ок-ль
H2S – 2e → S +2H+ 3 вос-ль
8H+
Cr2O72- +14H+ +3 H2S →2Cr3+ +7H2O +3S +6H+
3H2S + K2Cr2O7 +4 H2SO4 → 3S + Cr2(SO4)3 +7H2O + K2SO4
Слайд 15Самостоятельная работа
K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + …
H2O2 +
KI + H2SO4 + K2Cr2O7 → I2 + Cr2(SO4)3 + …
KMnO4 + HBr → MnBr2 +Br2 + …
PH3 + НBrO3 → H3PO4 + Br2 + …
PH3 + KMnO4 + H2SO4 → H3PO4 + …
Слайд 22Щелочная среда: недостаток атомов кислорода возмещаем гидроксид ионами, добавляем удвоенное их
MnSO4 + NaClO + NaOH → MnO2 +…
Mn2+ + 4OH- -2e → MnO2 +2H2O 1 вос-ль
ClO- + H2O +2e → Cl- +2OH- 1 ок-ль
2ОН- H2O
Mn2+ + 4OH- + ClO- + H2O → MnO2 +2H2O + Cl- +2OH-
MnSO4 + NaClO +2 NaOH → MnO2 + H2O + NaCl +Na2SO4
Слайд 23Самостоятельная работа
Cr2(SO4)3 +KClO3 +KOH → K2CrO4 + …
Cr2(SO4)3 +NaOH + H2O2
MnSO4 + KClO3 +KOH → K2MnO4 + ….
NH4OH + I2 + KOH → KI + N2 + …
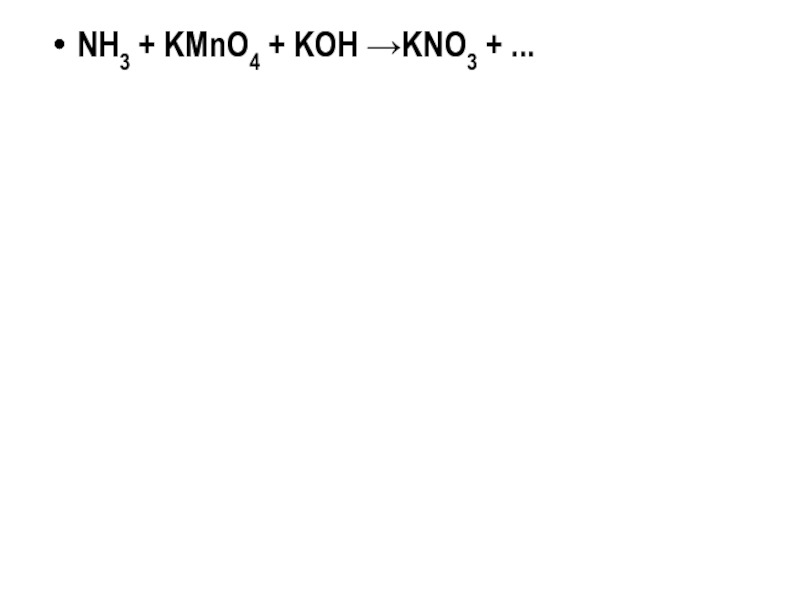
NH3 + KMnO4 + KOH →KNO3 + ...
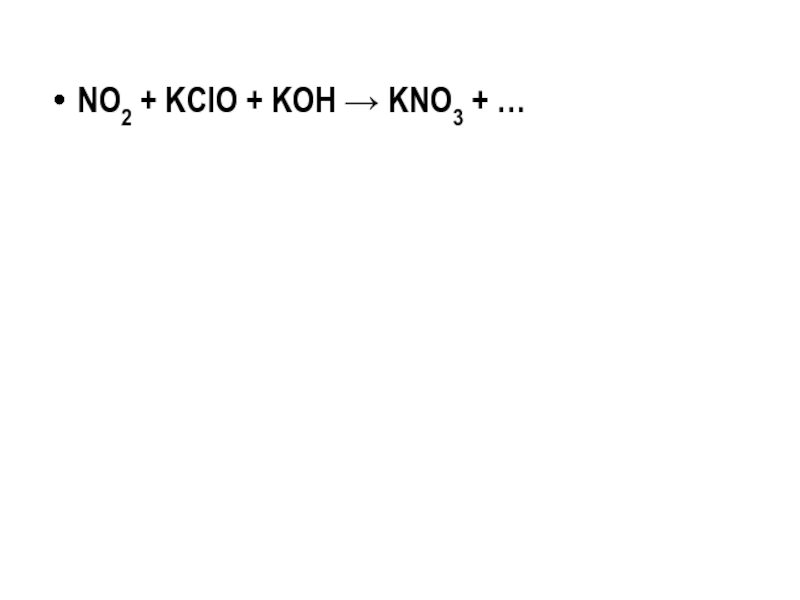
NO2 + KClO + KOH → KNO3 + …
Слайд 30Нейтральная среда: в левой части всегда пишем воду. В другую часть
SO2 + I2 + H2O → H2SO4 + …
I2 + 2e → 2I- 1 ок-ль
SO2 + 2H2O -2e → SO42- + 4H+ 1 вос-ль
I2 + SO2 + 2H2O → 2I- + SO42- + 4Н+
SO2 + I2 +2 H2O → H2SO4 + 2HI
Слайд 31Самостоятельная работа
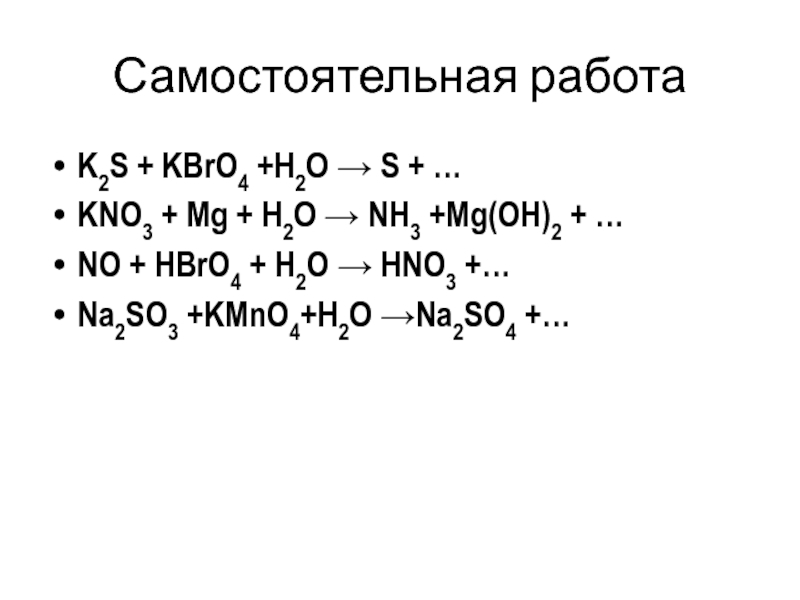
K2S + KBrO4 +H2O → S + …
KNO3 + Mg
NO + HBrO4 + H2O → HNO3 +…
Na2SO3 +KMnO4+H2O →Na2SO4 +…
Слайд 35PH3 + НBrO3 → H3PO4 + Br2 + …
KNO3 + Mg
NO + HBrO4 + … → HNO3 +Br2
K2S + KBrO4 + H2O → S + KBr + …
NH3 + KBrO4 → N2 + KBr + …
PH3 + KMnO4 + H2SO4 → H3PO4 + …
K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + …
KMnO4 + HBr → MnBr2 +Br2 + …
K2Cr2O7 + HI → I2 + CrI3 + …
H2O2 + KMnO4 + H2SO4 → MnSO4 + O2 + …
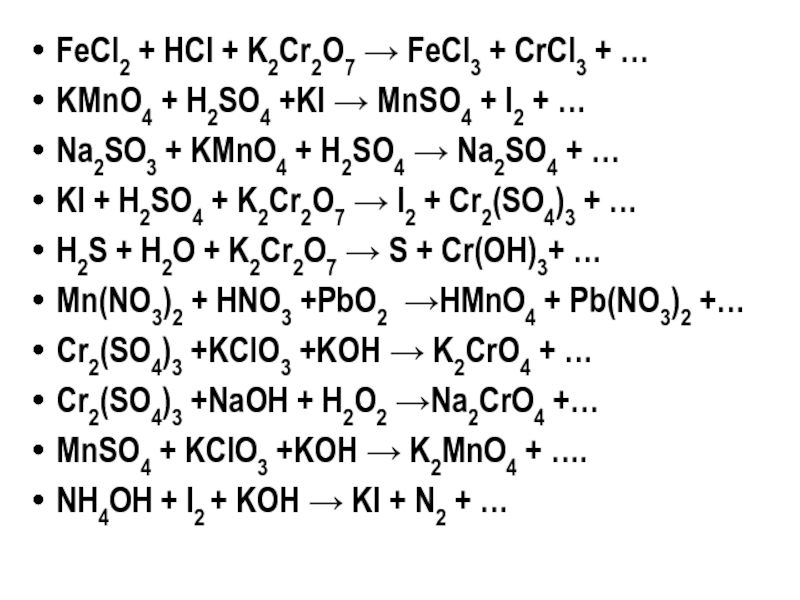
Слайд 36FeCl2 + HCl + K2Cr2O7 → FeCl3 + CrCl3 + …
KMnO4
Na2SO3 + KMnO4 + H2SO4 → Na2SO4 + …
KI + H2SO4 + K2Cr2O7 → I2 + Cr2(SO4)3 + …
H2S + H2O + K2Cr2O7 → S + Cr(OH)3+ …
Mn(NO3)2 + HNO3 +PbO2 →HMnO4 + Pb(NO3)2 +…
Cr2(SO4)3 +KClO3 +KOH → K2CrO4 + …
Cr2(SO4)3 +NaOH + H2O2 →Na2CrO4 +…
MnSO4 + KClO3 +KOH → K2MnO4 + ….
NH4OH + I2 + KOH → KI + N2 + …
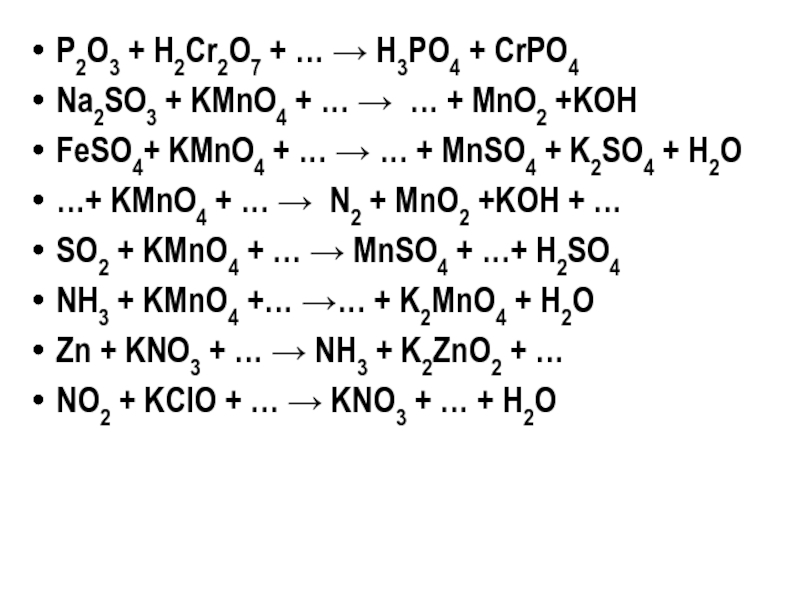
Слайд 37P2O3 + H2Cr2O7 + … → H3PO4 + CrPO4
Na2SO3 + KMnO4
FeSO4+ KMnO4 + … → … + MnSO4 + K2SO4 + H2O
…+ KMnO4 + … → N2 + MnO2 +KOH + …
SO2 + KMnO4 + … → MnSO4 + …+ H2SO4
NH3 + KMnO4 +… →… + K2MnO4 + H2O
Zn + KNO3 + … → NH3 + K2ZnO2 + …
NO2 + KClO + … → KNO3 + … + H2O
Слайд 38Окисление алкенов (кислая среда)
В результате разрыва двойной связи образуются кетоны, карбоновые
CH3–CH=CH–CH3+KMnO4+H2SO4 →СН3СООН+MnSO4 +
+K2SO4+H2O
C4H8 +4H2O – 8е → 2С2Н4О2 + 8Н+ 5
MnO4- +8Н+ + 5е → Mn2+ +4H2O 8
5C4H8+20H2O+8MnO4- +64Н+→10С2Н4О2 +40Н+ +8Mn2++32H2O
5CH3–CH=CH–CH3+8KMnO4+12H2SO4 →10СН3СООН+8MnSO4
+ 4K2SO4+12H2O
Слайд 39Окисление алкенов (кислая среда)
В результате разрыва двойной связи образуются кетоны, карбоновые
CH3–CH=CH2+K2Cr2O7+H2SO4 →СН3СООН+CO2+Cr2(SO4)3 +
+K2SO4+H2O
C3H6 +4H2O – 10е → С2Н4О2 +CO2+10Н+ 3
Cr2O72- +14Н+ + 6е → 2Cr3+ +7H2O 5
3C3H6+12H2O+5Cr2O72- +70Н+ →3С2Н4О+3CO2 +30Н+ +
+10Cr3++35H2O
3CH3–CH=CH2+5K2Cr2O7+20H2SO4→3СН3СООН+3CO2+
+5Cr2(SO4)3 +5K2SO4+23H2O
Слайд 40Окисление алкенов (кислая среда)
В результате разрыва двойной связи образуются кетоны, карбоновые
+KMnO4+H2SO4 →CH3COOH +
+MnSO4 +K2SO4+H2O
C5H10 +3H2O – 6е → С3Н6О+С2Н4О2+6Н+ 5
MnO4- +8Н+ + 5е → Mn2+ +4H2O 6
5C5H10+15H2O+6MnO4- +48Н+ →5С3Н6О+5C2H4O2 +30Н+
+6Mn2++24H2O
5 +6KMnO4+9H2SO4 →5СН3СООН+5
6MnSO4 + 3K2SO4+9H2O
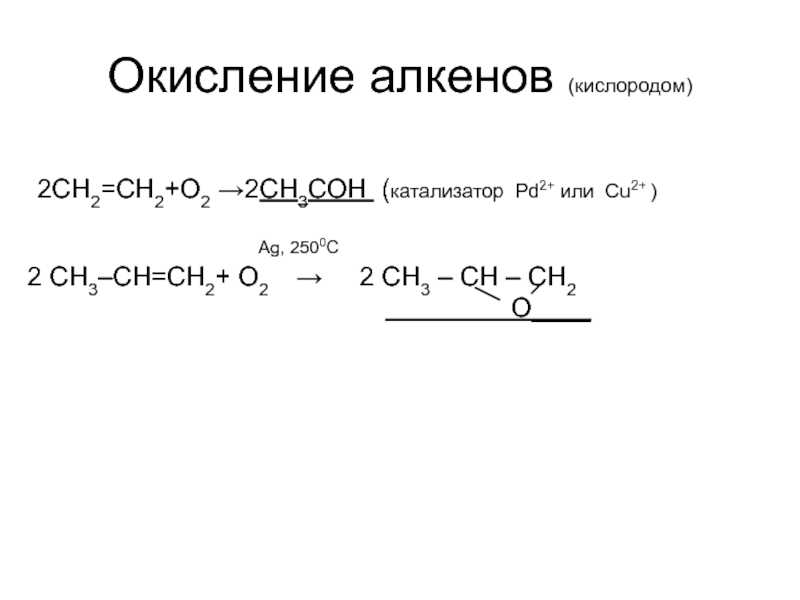
Слайд 41Окисление алкенов (кислородом)
2CH2=CH2+O2 →2СН3СОН (катализатор Pd2+ или Cu2+ )
Ag, 2500C
2 CH3–CH=CH2+ O2 → 2 CH3 – CH – CH2
O____
Слайд 42Окисление алкинов (кислая среда)
CH3–C≡C–СН2 –CH3+KMnO4+H2SO4→СН3СООН+С2Н5СООН
C5H8 +4H2O – 6е → С2Н4О2+С3Н6О2 +6Н+ 5
MnO4- +8Н+ + 5е → Mn2+ +4H2O 6
5C5H8+20H2O+6MnO4- +48Н+ →5С2Н4О2 +5С3Н6О2 + 30Н+ +
+ 6Mn2++24H2O
5CH3–C≡C–СН2 –CH3+6KMnO4+9H2SO4→5СН3СООН+
+5С2Н5СООН+6MnSO4 +3K2SO4+4H2O
Слайд 43Окисление алкинов (нейтральная среда)
CН≡CH+KMnO4→КООС – СООК+MnO2+KOH + H2O
C2H2
MnO4- +2H2O + 3е → MnО2 +4OН- 8
3C2H2+12H2O+8MnO4- +16H2O → 6СОО-+30Н+ +8MnO2 +32OН-
3CН≡CH+8KMnO4→3КООС – СООК+8MnO2+2KOH +2H2O
Слайд 44Окисление алкинов (нейтральная среда)
СН3 – C≡CH+H2O+KMnO4→СН3СООK+КНСО3 +MnO2+KOH
C3H4 +5H2O –
MnO4- +2H2O + 3е → MnО2 +4OН- 8
3C3H4+15H2O+8MnO4- +16H2O → 3CH3СОО- + 3HCO3- + 30Н+
+8MnO2 +32OН-
3СН3 – C≡CH + H2O + 8KMnO4→3СН3СООK + 3КНСО3 +
+ 8MnO2 + 2KOH
Слайд 45Окисление алкинов (щелочная среда)
CH3–C≡CH+KMnO4+KOH→СН3СООК+К2СО3 +K2MnO4+ H2O
C3H4 +11OH- –
MnO4- + е → MnО42- 8
C3H4+ 11OH- +8MnO4- → СН3СОО-+ СО32- + 6H2O + 8MnО42-
CH3–C≡CH+8KMnO4+11KOH→СН3СООК+К2СО3 +8K2MnO4+
+ 6H2O
Слайд 46Окисление аренов (кислая среда)
С6H5 – CH3 +KMnO4+H2SO4→С6Н5СООН+MnSO4 +K2SO4+H2O
C7H8 +2H2O
MnO4- +8Н+ + 5е → Mn2+ +4H2O 6
5C7H8+10H2O+6MnO4- +48Н+ →5С7Н6О2 + 30Н+ +6Mn2++24H2O
5 С6H5 – CH3 +6KMnO4+9H2SO4→ 5С6Н5СООН+6MnSO4 +
+3K2SO4+14H2O
Слайд 47Окисление аренов (кислая среда)
С6H5СН2 – CH3 +KMnO4+H2SO4→С6Н5СООН +CO2+ MnSO4
C8H10 +4H2O – 12е → С7Н6О2 + CO2 +12Н+ 5
MnO4- +8Н+ + 5е → Mn2+ +4H2O 12
5C8H10+20H2O+12MnO4- +96Н+ →5С7Н6О2 + 5CO2 + 60Н+ +
+12Mn2++48H2O
5С6H5СН2 – CH3 +12KMnO4+18H2SO4→5С6Н5СООН +5CO2+
12MnSO4 +6K2SO4+28H2O
Слайд 48Окисление аренов (щелочная среда)
С6H5 – CH3 +KMnO4+KOH→С6Н5СООК + K2MnO4+ H2O
MnO4- + е → MnО42- 6
C7H8+ 7OH- +6MnO4- → С6Н5СОО-+ 5H2O + 6MnО42-
С6H5 – CH3 +6KMnO4+7KOH→ С6Н5СООК +6K2MnO4+ 5H2O
Слайд 49Окисление аренов (щелочная среда)
С6H5СН2–CH3+KMnO4+KOH→С6Н5СООК +К2СО3+K2MnO4+H2O
C8H10 +15OH- – 12е
MnO4- + е → MnО42- 12
C8H10+15OH- +12MnO4- →С6Н5СОО-+ СО32- +10H2O + 12MnО42-
С6H5СН2–CH3+12KMnO4+15KOH→С6Н5СООК +К2СО3+
+ 12K2MnO4+10H2O
Слайд 50Окисление аренов (нейтральная среда)
С6H5 – CH3 +KMnO4→С6Н5СООK+MnO2+KOH + H2O
MnO4- +2H2O + 3е → MnО2 +4OН- 2
C7H8+2H2O+2MnO4- +4H2O →С6Н5СОО- + 7Н++2MnO2 +8OН-
С6H5 – CH3 +2KMnO4→С6Н5СООK+2MnO2+KOH + H2O
Слайд 51Окисление аренов (нейтральная среда)
С6H5СН2 – CH3+KMnO4→С6Н5СООK+ К2СО3+ MnO2+KOH + H2O
MnO4- +2H2O + 3е → MnО2 +4OН- 4
C8H10+5H2O+4MnO4- +8H2O→С6Н5СОО- +CO32-+15Н+ +
+4MnO2 +16OН-
С6H5 – СН2 – CH3 +4KMnO4→С6Н5СООK+ К2СО3 +4MnO2 +KOH +2H2O
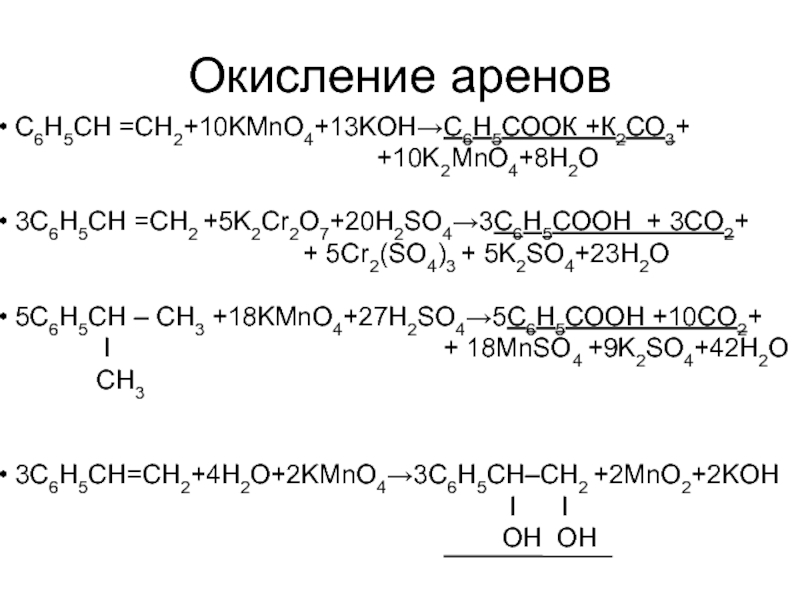
Слайд 52Окисление аренов
С6H5СН =CH2+10KMnO4+13KOH→С6Н5СООК +К2СО3+
3С6H5СН =CH2 +5K2Cr2O7+20H2SO4→3С6Н5СООН + 3CO2+
+ 5Cr2(SO4)3 + 5K2SO4+23H2O
5С6H5СН – CH3 +18KMnO4+27H2SO4→5С6Н5СООН +10CO2+
I + 18MnSO4 +9K2SO4+42H2O
CH3
3С6H5СН=CH2+4H2O+2KMnO4→3С6H5СН–CH2 +2MnO2+2KOH
I I
OH OH
Слайд 53Окисление аренов
5
фталевая кислота
+ 10CO2+ 24MnSO4 +12K2SO4+56H2O
CH2 –CH3
CH2 –CH3
COOH
COOH
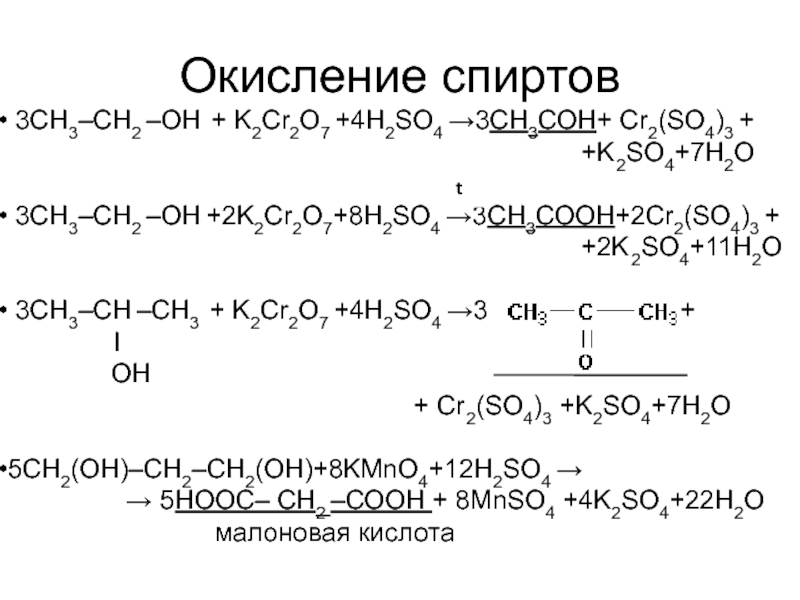
Слайд 54Окисление спиртов
3CH3–CH2 –ОН + K2Cr2O7 +4H2SO4 →3СН3СОН+ Cr2(SO4)3 +
+K2SO4+7H2O
3CH3–CH2 –ОН +2K2Cr2O7+8H2SO4 →3СН3СОOН+2Cr2(SO4)3 +
+2K2SO4+11H2O
3CH3–CH –CH3 + K2Cr2O7 +4H2SO4 →3 +
I
OH
+ Cr2(SO4)3 +K2SO4+7H2O
5CH2(OH)–CH2–CH2(OH)+8KMnO4+12H2SO4 →
→ 5HOOС– CH2 –СООН + 8MnSO4 +4K2SO4+22H2O
малоновая кислота
t
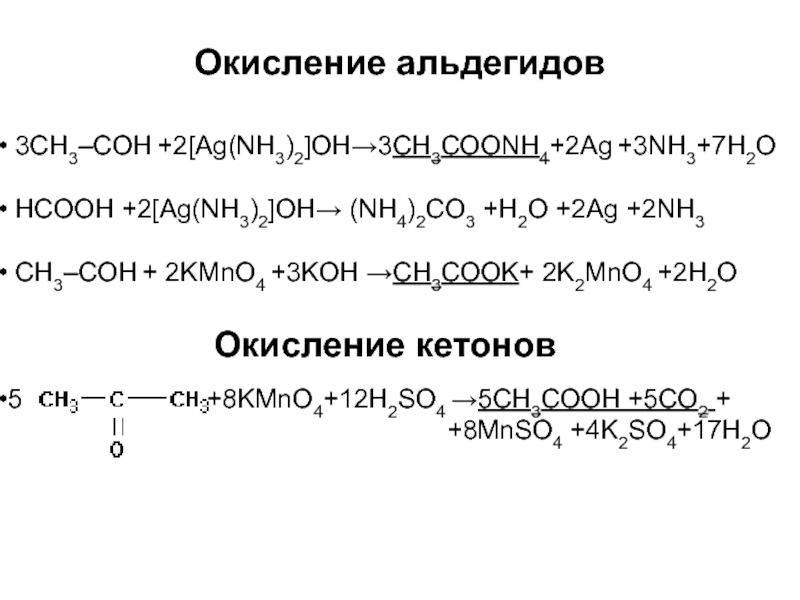
Слайд 55Окисление альдегидов
3CH3–CОН +2[Ag(NH3)2]OH→3СН3СОONH4+2Ag +3NH3+7H2O
HCOOH +2[Ag(NH3)2]OH→ (NH4)2CO3 +H2O +2Ag +2NH3
CH3–CОН + 2KMnO4 +3KOH →СН3СОOK+ 2K2MnO4 +2H2O
5 +8KMnO4+12H2SO4 →5СН3СООН +5СO2 +
+8MnSO4 +4K2SO4+17H2O
Окисление кетонов
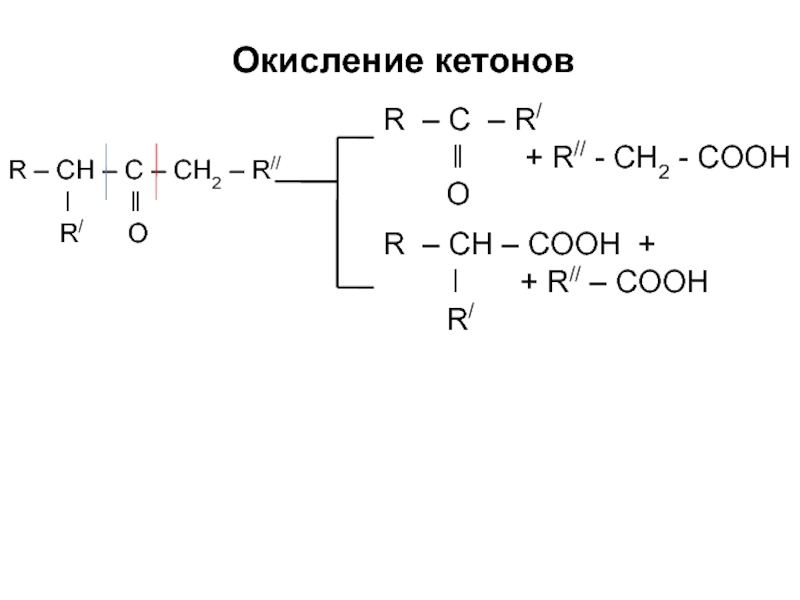
Слайд 56
R – CH – C – CH2 – R//
ǀ ǁ
R/ O
Окисление кетонов
R – C – R/
ǁ + R// - CH2 - COOH
O
R – CH – COOH +
ǀ + R// – COOH
R/
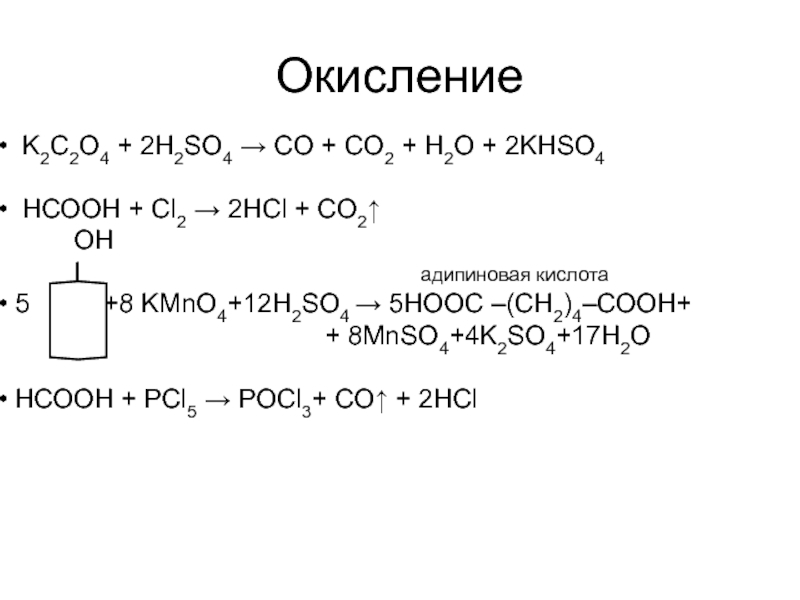
Слайд 57Окисление
K2C2O4 + 2H2SO4 → CO + CO2 + H2O + 2KHSO4
НСООН + Cl2 → 2HCl + CO2↑
OH
I адипиновая кислота
5 +8 KMnO4+12H2SO4 → 5HООС –(CH2)4–СООH+
+ 8MnSO4+4K2SO4+17H2O
НСООН + PCl5 → POCl3+ CO↑ + 2HCl
Слайд 595PH3 + 8НBrO3 →5 H3PO4 + 4Br2 + 4 H2O
KNO3 +
14NO + 6HBrO4 +4 H2O →14 HNO3 +3Br2
4K2S + KBrO4 +4 H2O → 4S + KBr + 8KOH
8NH3 + 3KBrO4 → 4N2 + 3KBr +12H2O
5PH3+8KMnO4+12H2SO4 →5H3PO4+ 8MnSO4+ +4K2SO4+ 12H2O
K2Cr2O7 +3K2SO3+4H2SO4→Cr2(SO4)3+4K2SO4+4 H2O
2KMnO4 + 16HBr → 2MnBr2 + 5Br2 + 2KBr + 8H2O
K2Cr2O7 + 14HI → 3I2 + 2CrI3 + 2KI +7H2O
5H2O2+2KMnO4+3H2SO4→2MnSO4+5O2+K2SO4+8H2O
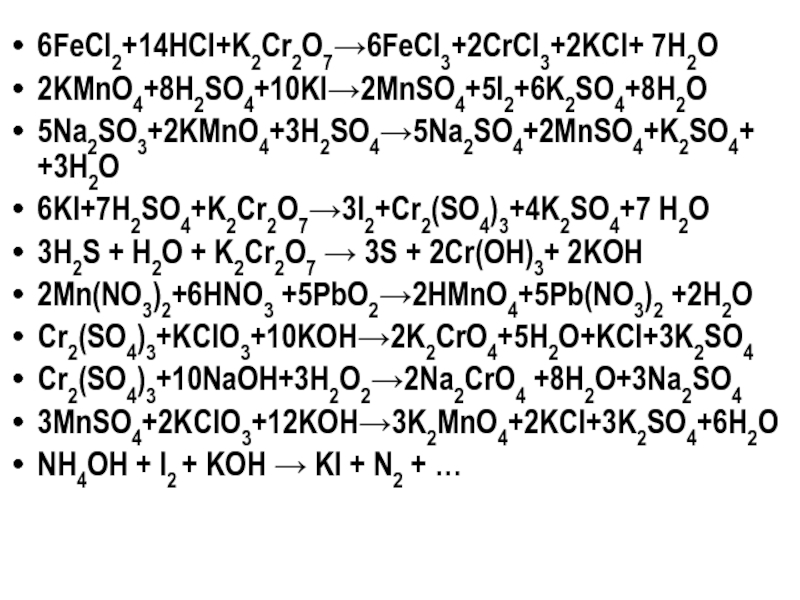
Слайд 606FeCl2+14HCl+K2Cr2O7→6FeCl3+2CrCl3+2KCl+ 7H2O
2KMnO4+8H2SO4+10KI→2MnSO4+5I2+6K2SO4+8H2O
5Na2SO3+2KMnO4+3H2SO4→5Na2SO4+2MnSO4+K2SO4+ +3H2O
6KI+7H2SO4+K2Cr2O7→3I2+Cr2(SO4)3+4K2SO4+7 H2O
3H2S + H2O + K2Cr2O7 → 3S +
2Mn(NO3)2+6HNO3 +5PbO2→2HMnO4+5Pb(NO3)2 +2H2O
Cr2(SO4)3+KClO3+10KOH→2K2CrO4+5H2O+KCl+3K2SO4
Cr2(SO4)3+10NaOH+3H2O2→2Na2CrO4 +8H2O+3Na2SO4
3MnSO4+2KClO3+12KOH→3K2MnO4+2KCl+3K2SO4+6H2O
NH4OH + I2 + KOH → KI + N2 + …
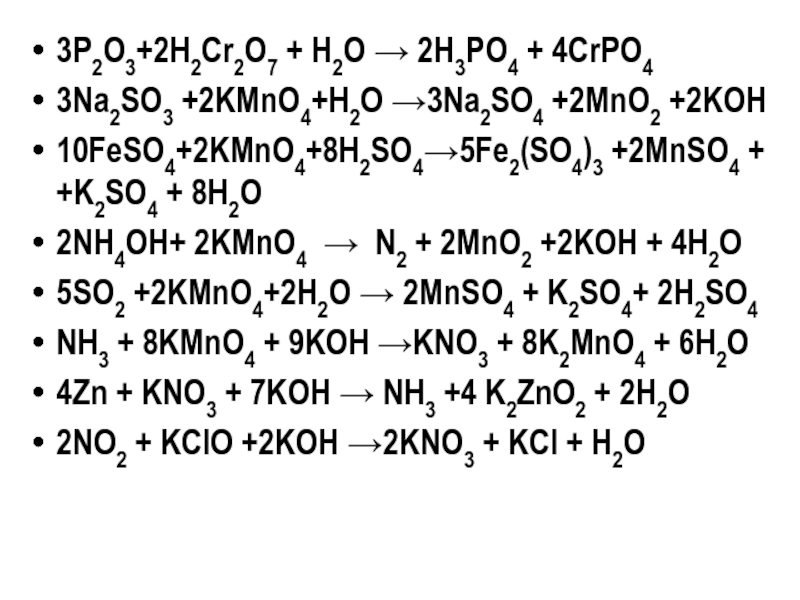
Слайд 613P2O3+2H2Cr2O7 + H2O → 2H3PO4 + 4CrPO4
3Na2SO3 +2KMnO4+H2O →3Na2SO4 +2MnO2 +2KOH
10FeSO4+2KMnO4+8H2SO4→5Fe2(SO4)3
2NH4OH+ 2KMnO4 → N2 + 2MnO2 +2KOH + 4H2O
5SO2 +2KMnO4+2H2O → 2MnSO4 + K2SO4+ 2H2SO4
NH3 + 8KMnO4 + 9KOH →KNO3 + 8K2MnO4 + 6H2O
4Zn + KNO3 + 7KOH → NH3 +4 K2ZnO2 + 2H2O
2NO2 + KClO +2KOH →2KNO3 + KCl + H2O