- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии. Обучающий тест для подготовки экзамена.
Содержание
- 1. Презентация по химии. Обучающий тест для подготовки экзамена.
- 2. ОГЭ «Химия»
- 3. Слайд 3
- 4. Инструкция для обучающихся 1.Интерактивный тест включает в
- 5. А 1.В атоме химического элемента, расположенном в
- 6. Положение элемента в ПС отражает строение его атомов
- 7. Периодическая система химических элементов Д.И. Менделеева№ группы
- 8. Электронная оболочка – это совокупность
- 9. Строение электронной оболочки Строение электронных оболочек
- 10. Строение атома Строение атомаАтомЯдроЭлектронная
- 11. А 2.В каком ряду химических элементов усиливаются
- 12. Свойства неметалловНеметаллические свойства – это способность атомов притягивать электроны на внешнюю электронную оболочку. SS +16+163232286288+ 2е-
- 13. Периодическое изменение свойств элементов В периодах слева
- 14. В группах сверху вниз:Элементы V A группы1.Увеличивается
- 15. А 3. Ковалентную неполярную связь имеет
- 16. Основные типы химической связиИоннаяКовалентнаяМеталлическаяВодороднаяОбразуется в результате электростатического
- 17. А 4Свою высшую степень окисления элемент имеет
- 18. +3+6Степень окисления-это условный заряд атомов хим. элемента
- 19. А 5Вещества, формулы которых – Fe2O3 и
- 20. ЭхОуCaO, SO3, Mn2O7, FeO, CO2, Cu2ONO, CO, N2O, SiO, NO2
- 21. Оксиды солеобразующие
- 22. кислоты -это сложные вещества, состоящие из атомов
- 23. Основания –это сложные вещества, состоящие из ионов
- 24. Соли –это сложные вещества, состоящие из ионов
- 25. А 6.Какое уравнение соответствует реакции обмена?
- 26. Классификация химических реакций по числу и составу
- 27. Реакции ионного обмена Идут до конца:CuSO4
- 28. А 7.С образованием катионов водорода в водных
- 29. Диссоциация кислот Кислоты-это сложные вещества, при
- 30. Диссоциация оснований Основания-это сложные вещества, при
- 31. Диссоциация солей Соли - это сложные
- 32. А 8.Газ не выделяется при взаимодействии водных
- 33. Нестабильные кислоты, основанияСернистая кислотаУгольная кислотаГидроксид аммонияH2SO3
- 34. А 9.С литием реагирует
- 35. Химические свойства металлов1.С неметаллами (O2, H2, N2,
- 36. А 10.Оксид фосфора (V) реагирует с
- 37. Химические свойства оксидов
- 38. А 11.Соляная кислота реагирует
- 39. Химические свойства кислот1.Действие на индикаторы.2.С активными металлами
- 40. А 12Раствор карбоната натрия может взаимодействовать
- 41. Химические свойства солей1.Соль 1 +кислота 1 =соль
- 42. А 13Верны ли следующие суждения о правилах
- 43. А14.Азот является окислителем в реакции
- 44. Окислительно-восстановительные реакцииХимические реакции, в результате которых происходит
- 45. А 15.На какой диаграмме распределение массовых долей
- 46. Массовая доля элемента(Э)= n. Ar (Э)Mrn-число атомовAr(Э)-относительная масса элементаMr-относительная молекулярная масса вещества
- 47. ЛитератураХимия 8,9 класс. О.С. Габриелян. Дрофа. Москва.
- 48. Интернет - ресурсыhttp://омск104.боусош.рф(Знаешь, значит сдашь. плакат)http://schools.dnevnik.ru/news.aspx?network=43913&news=505787(Все решают
Слайд 1Химия 9
Основной государственный экзамен по химии.
Тест.
Автор: Ширяева Екатерина
учитель МБОУ «СОШ № 31» п. Восток
Красноармейского муниципального района
Приморского края
Слайд 4Инструкция для обучающихся
1.Интерактивный тест включает в себя 15 вопросов.
2. Для
3. Выберите правильный ответ из предложенных вариантов и щелкните по нему.
4. При правильном ответе появляется зелёный круг , при неправильном – красный .
5. Для перехода к следующему вопросу используйте кнопку
6.Если вы ответили неправильно, щелкните на вставку
7. Для повторного выполнения задания используйте управляющую кнопку
Изучи теорию!
Слайд 5А 1.
В атоме химического элемента, расположенном в третьем периоде, VА группе
1) 3 2)5 3) 15 4) 31
Изучи теорию!
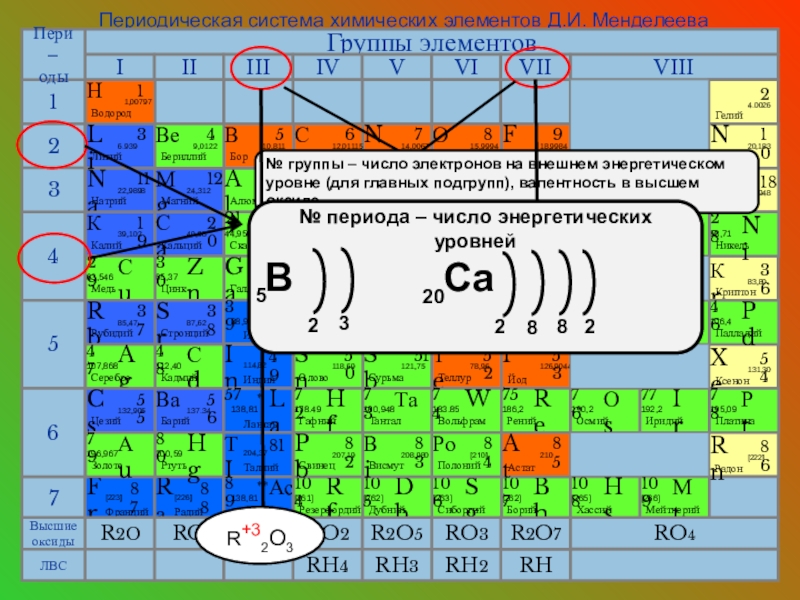
Слайд 7Периодическая система химических элементов Д.И. Менделеева
№ группы – число электронов на
7
R+32O3
№ периода – число энергетических уровней
B Ca
5
20
2
3
2
8
8
2
Слайд 8 Электронная оболочка – это совокупность электронов, двигающихся вокруг ядра
Строение электронных оболочек атомов
Электроны в электронной оболочке располагаются на энергетических уровнях.
n – главное квантовое число – определяет число энергетических уровней .
Номер периода совпадает с числом энергетических уровней элемента.
Период
3
Группа
VI
3
Число электронов (N) на уровне рассчитывается по формуле.
N = 2n2
n = 1, N = 2 . 12 = 2
2
n = 2, N = 2 . 22 = 8
8
Номер группы совпадает с числом электронов на последнем энергетическом уровне.
6
Общее число электронов
е = 16
Проверка
16
Слайд 9 Строение электронной оболочки
Строение электронных оболочек атомов
Энергетический уровень состоит
2
8
5
Первый уровень
s – орбиталь
Второй уровень
s – орбиталь
p – орбиталь
Третий уровень
s – орбиталь
p – орбиталь
d – орбиталь
Орбиталь состоит из квантовых ячеек.
квантовая
ячейка
Слайд 10
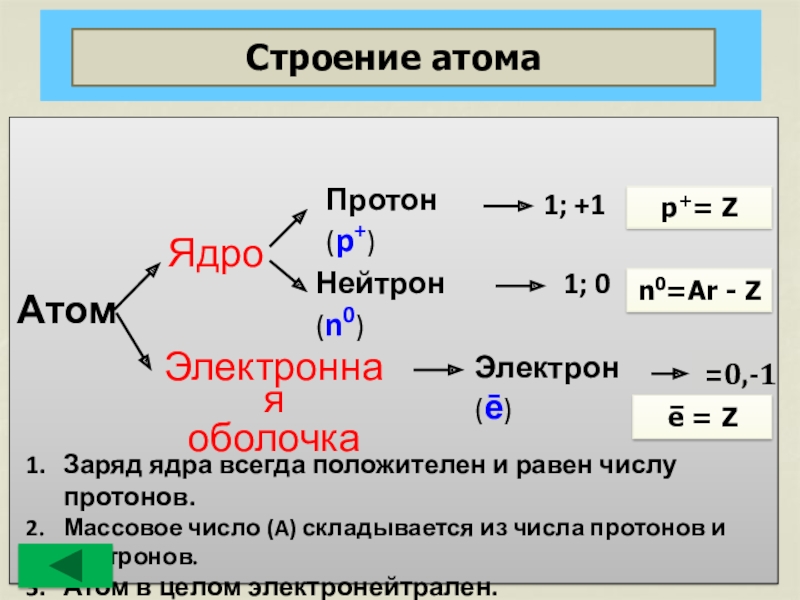
Строение атома
Строение атома
Атом
Ядро
Электронная оболочка
Протон
Нейтрон (n0)
1; +1
1; 0
Электрон (ē)
=0,-1
Заряд ядра всегда положителен и равен числу протонов.
Массовое число (A) складывается из числа протонов и нейтронов.
Атом в целом электронейтрален.
p+= Z
n0=Ar - Z
e = Z
Слайд 11А 2.
В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им
1) барий магний кальций
2) германий кремний углерод
3) литий натрий калий
4) кислород азот углерод
Изучи теорию!
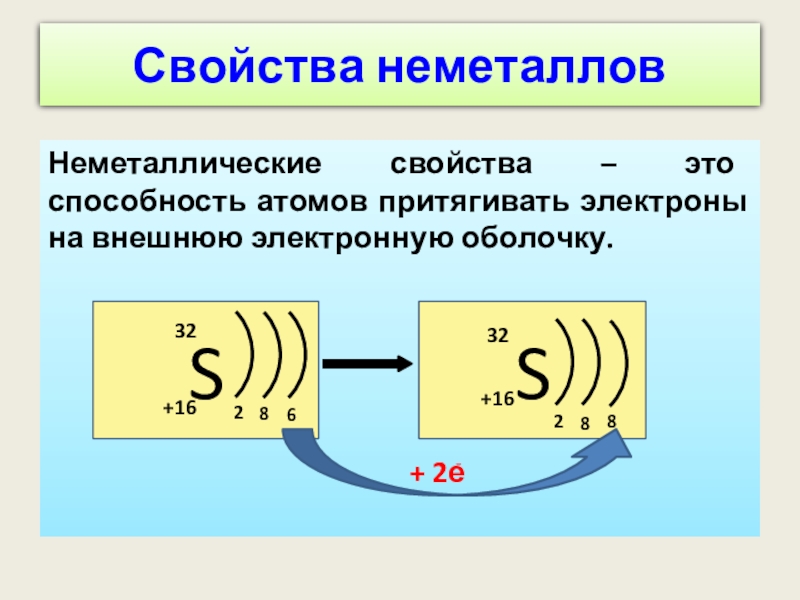
Слайд 12Свойства неметаллов
Неметаллические свойства – это способность атомов притягивать электроны на внешнюю
S
S
+16
+16
32
32
2
8
6
2
8
8
+ 2е
-
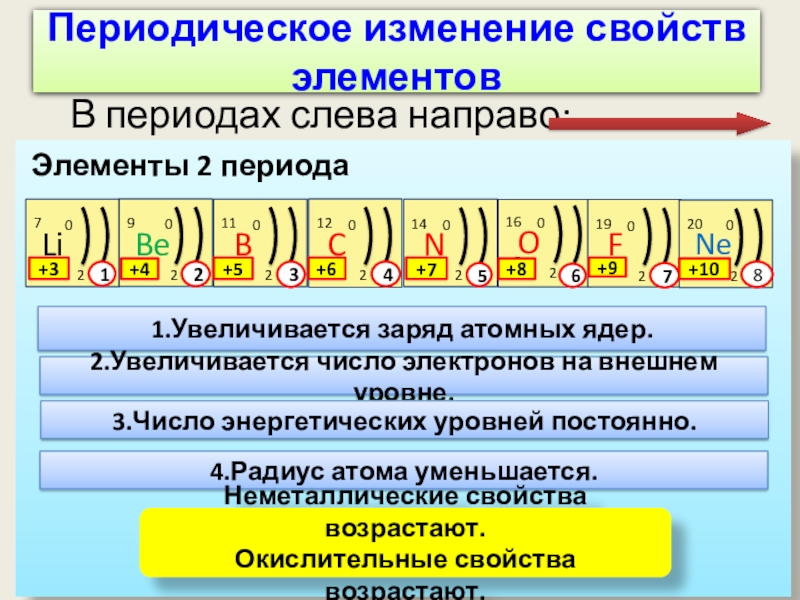
Слайд 13Периодическое изменение свойств элементов
В периодах слева направо:
Элементы 2 периода
1.Увеличивается заряд
2.Увеличивается число электронов на внешнем уровне.
3.Число энергетических уровней постоянно.
4.Радиус атома уменьшается.
Неметаллические свойства возрастают.
Окислительные свойства возрастают.
1
2
3
4
5
6
7
8
+3
+4
+5
+6
+7
+8
+9
+10
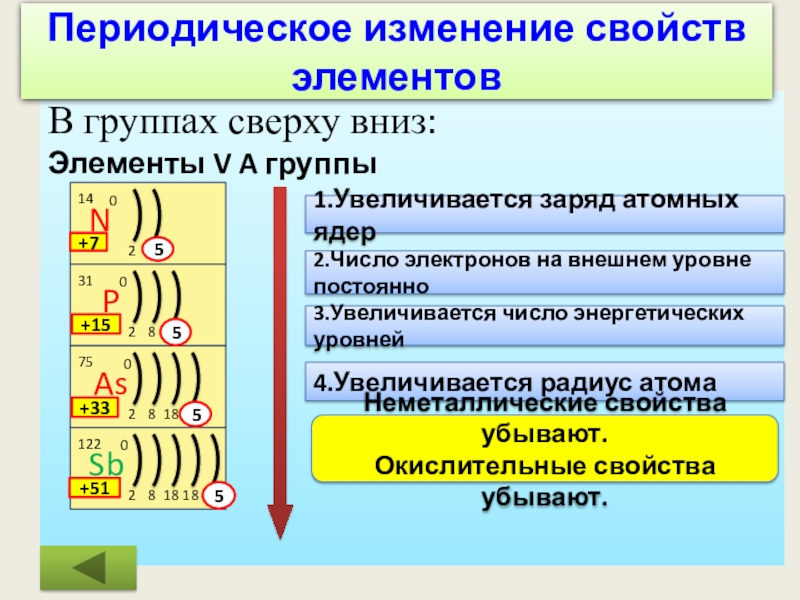
Слайд 14В группах сверху вниз:
Элементы V A группы
1.Увеличивается заряд атомных ядер
2.Число электронов
3.Увеличивается число энергетических уровней
4.Увеличивается радиус атома
Неметаллические свойства убывают.
Окислительные свойства убывают.
+7
+15
+33
+51
5
5
5
5
Периодическое изменение свойств элементов
Слайд 15А 3.
Ковалентную неполярную связь имеет
2) оксид серы (VI)
3) сульфид калия
4) сероводород
Изучи теорию!
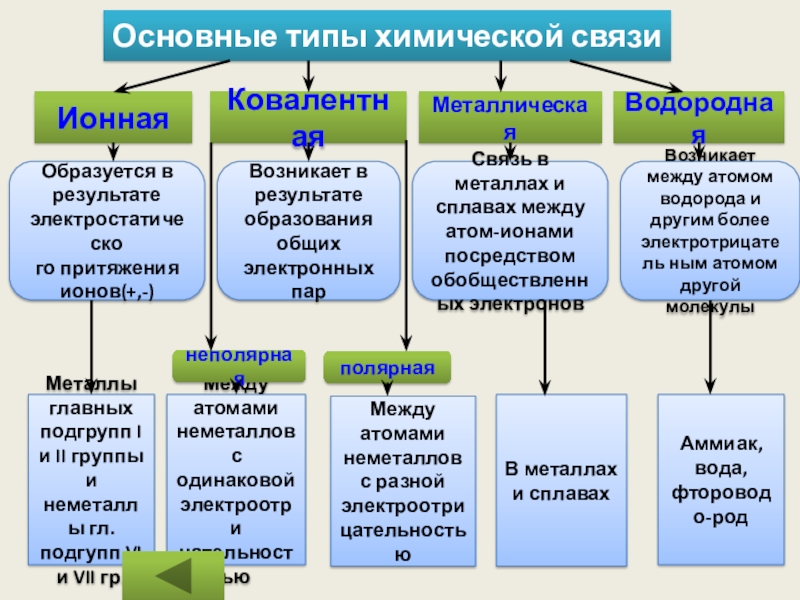
Слайд 16Основные типы химической связи
Ионная
Ковалентная
Металлическая
Водородная
Образуется в результате электростатическо
го притяжения ионов(+,-)
Возникает в результате
Связь в металлах и сплавах между атом-ионами посредством обобществленных электронов
Возникает между атомом водорода и другим более электротрицатель ным атомом другой молекулы
Металлы главных подгрупп I и II группы и неметаллы гл.подгупп VI и VII гр.
Между атомами неметаллов с одинаковой электроотри
цательностью
Между атомами неметаллов с разной электроотри
цательностью
В металлах и сплавах
Аммиак, вода, фтороводо-род
неполярная
полярная
Слайд 17А 4
Свою высшую степень окисления элемент имеет в оксиде, формула которого
1) CaO
2) P2O3
3) Cl2O5
4) NO2
Изучи теорию!
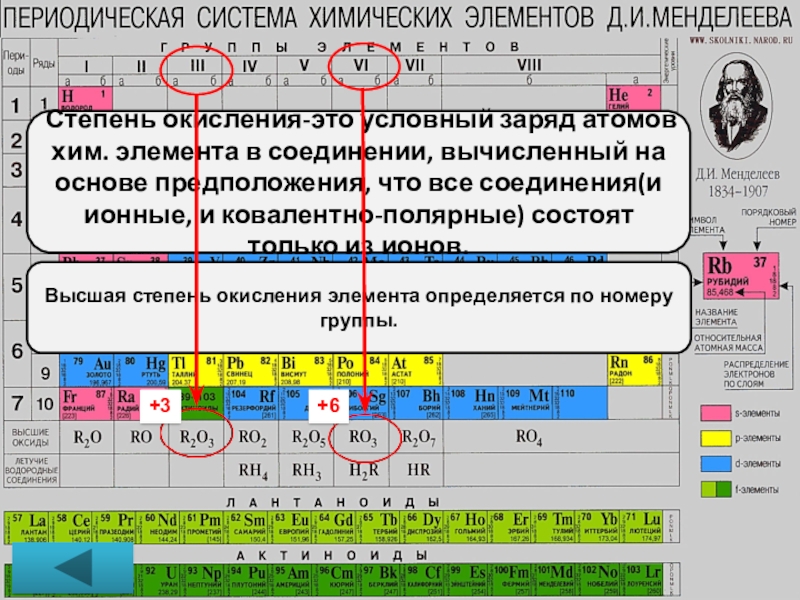
Слайд 18+3
+6
Степень окисления-это условный заряд атомов хим. элемента в соединении, вычисленный на
Высшая степень окисления элемента определяется по номеру группы.
Слайд 19А 5
Вещества, формулы которых – Fe2O3 и FeCl2, являются соответственно
2)амфотерным оксидом и кислотой
3)амфотерным оксидом и солью
4)кислотой и амфотерным
гидроксидом
Изучи теорию!
Слайд 22кислоты -это сложные вещества, состоящие из атомов водорода, способных замещаться на
HCl
H2SO4
H3PO4
H2SiO3
HNO3
H2SO4
Кислоты
Бескислородные HCl , H2S
Одноосновные HBr, HNO2
Двухосновные H2SO3, H2CO3
Трехосновные H3PO4
Растворимые HNO3, HCl
Нерастворимые H2SiO3,
Сильные H2SO4, HNO3
Слабые H2CO3, H2SO3
Кислородсодержащие H2CO3, HNO3
Летучие HCl , HNO3
Нелетучие H3PO4, H2SiO3
Стабильные HCl, H2SO4
Нестабильные H2SiO3, H2CO3
Слайд 23Основания –это сложные вещества, состоящие из ионов металлов и связанных сними
Основания
Растворимые NaOH, Ca(OH)2
Нерастворимые Cu(OH)2, Fe(OH)3
Однокислотные KOH, LiOH
Двухкислотные Ba(OH)2, Mg(OH)2
Сильные щелочи
Слабые NH3.H2O, Mg(OH)2
NaOH
Ca(OH)2
Zn(OH)2
Al(OH)3
Fe(OH)2
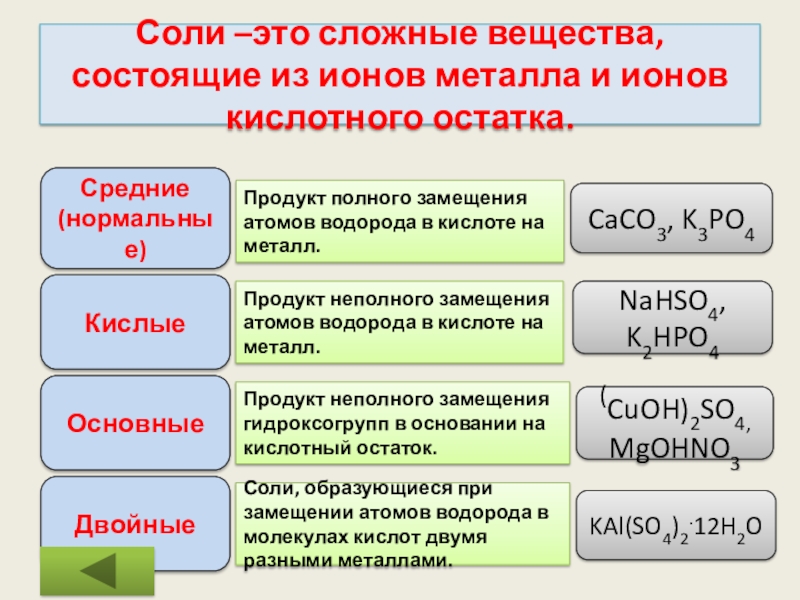
Слайд 24Соли –это сложные вещества, состоящие из ионов металла и ионов кислотного
Средние
(нормальные)
Кислые
Основные
Двойные
Продукт полного замещения атомов водорода в кислоте на металл.
Продукт неполного замещения атомов водорода в кислоте на металл.
Продукт неполного замещения гидроксогрупп в основании на кислотный остаток.
Соли, образующиеся при замещении атомов водорода в молекулах кислот двумя разными металлами.
CaCO3, K3PO4
NaHSO4,
K2HPO4
(CuOH)2SO4,
MgOHNO3
KAl(SO4)2.12H2O
Слайд 25А 6.
Какое уравнение соответствует реакции обмена?
1) MgO+CO2 =MgCO3
2) FeCl3+3NaOH =3NaCl +Fe(OH)3
3)2NaI + Br2 =2NaBr +I2
4) 2AgBr = 2Ag + Br2
Изучи теорию!
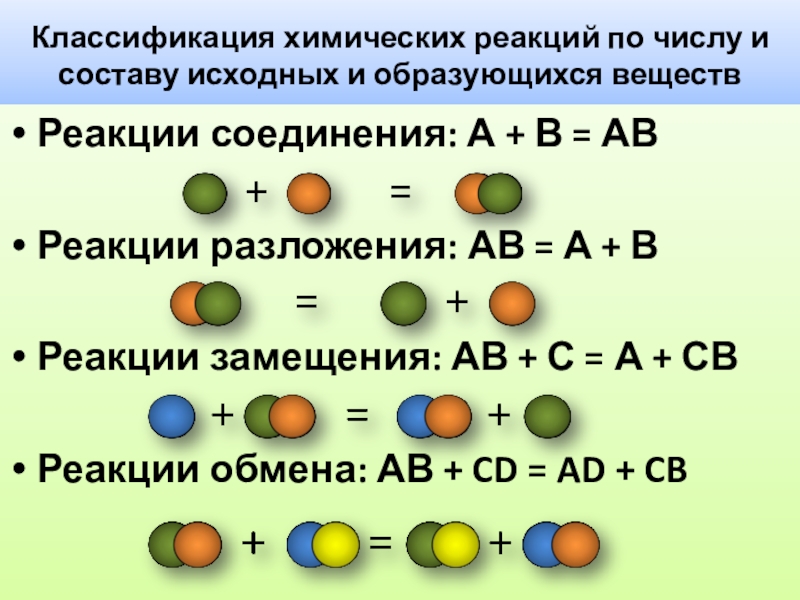
Слайд 26Классификация химических реакций по числу и составу исходных и образующихся веществ
Реакции
Реакции разложения: АВ = А + В
Реакции замещения: АВ + С = А + СВ
Реакции обмена: АВ + CD = AD + CB
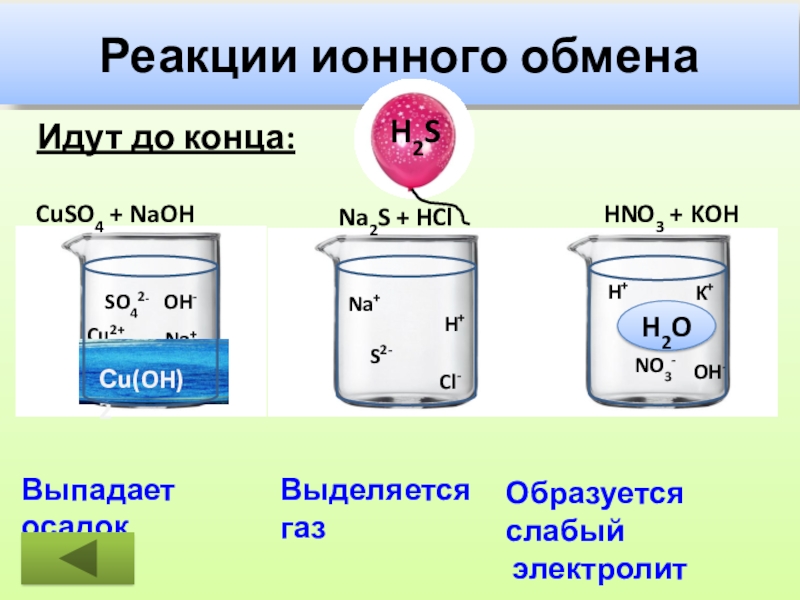
Слайд 27Реакции ионного обмена
Идут до конца:
CuSO4 + NaOH
Na2S +
HNO3 + KOH
Cu2+
SO42-
Na+
OH-
Na+
S2-
H+
Cl-
H+
NO3-
K+
OH-
Сu(OH)2
H2S
H2O
Выпадает осадок
Выделяется газ
Образуется слабый
электролит
Слайд 28А 7.
С образованием катионов водорода в водных растворах диссоциируют
2) основания
3) средние соли
4) кислоты
Изучи теорию!
Слайд 29
Диссоциация кислот
Кислоты-это сложные вещества, при диссоциации которых в водных растворах в
НCl Н+ + Cl -
Н2SO4 2Н+ + SO4 2-
Н2 CO3 2Н+ + CO3 2-
Н+
Слайд 30
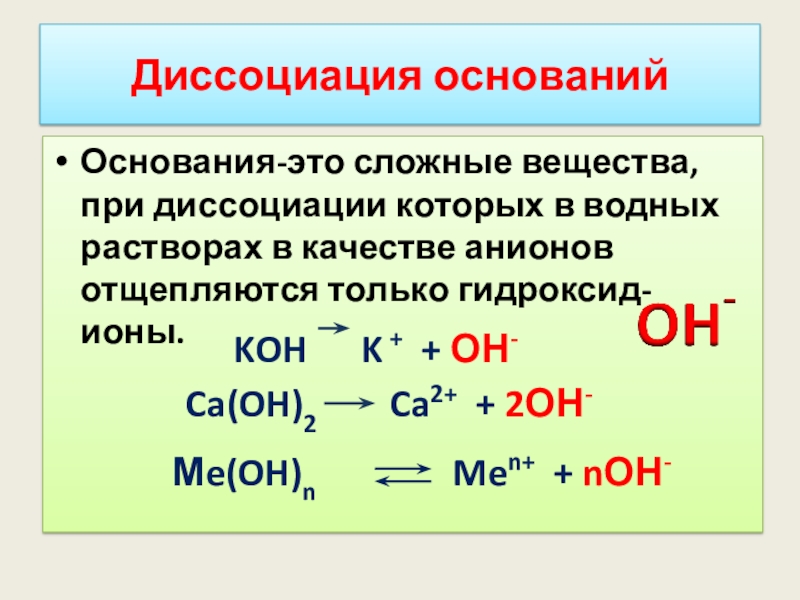
Диссоциация оснований
Основания-это сложные вещества, при диссоциации которых в водных растворах в
KOH K + + ОН-
Ca(OH)2 Ca2+ + 2ОН-
Мe(OH)n Men+ + nОН-
Слайд 31
Диссоциация солей
Соли - это сложные вещества, которые в водных растворах диссоциируют
NaCl Na+ +Cl-
K2SO4 2 K+ + SO42-
Al(NO3)3 Al3++ 3NO3-
Men+
(кислотный остаток)m-
Слайд 32А 8.
Газ не выделяется при взаимодействии водных растворов
2) Na2CO3 и Ba(OH)2
3) Na2SO3 и H2SO4
4) HNO3 и K2CO3
Изучи теорию!
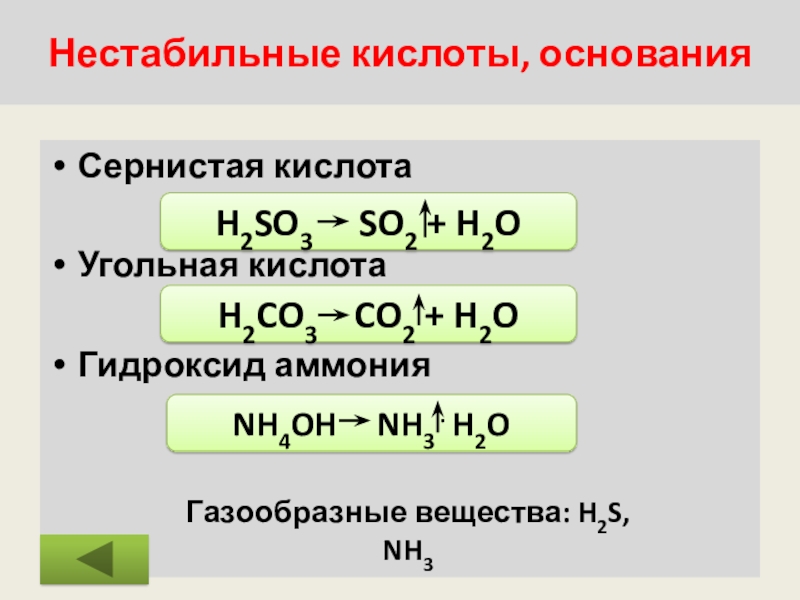
Слайд 33Нестабильные кислоты, основания
Сернистая кислота
Угольная кислота
Гидроксид аммония
H2SO3 SO2 + H2O
H2CO3
Газообразные вещества: H2S, NH3
NH4OH NH3 . H2O
Слайд 35Химические свойства металлов
1.С неметаллами (O2, H2, N2, S, галогенами и др.).
2.С
3.С кислотами.
4.С солями менее активных металлов в растворе.
5.Со щелочами (амфотерные металлы).
Слайд 36А 10.
Оксид фосфора (V) реагирует с
2)оксидом серы (IV)
3) сероводородом
4) аммиаком
Изучи теорию!
Слайд 39Химические свойства кислот
1.Действие на индикаторы.
2.С активными металлами (металлы в ряду напряжений
3.С основными оксидами.
4.С основаниями.
5.С солями (если образуется осадок, газ, слабый электролит).
Красный
Розовый
бесцветный
лакмус
фенолфталеин
метилоранж
Слайд 40А 12
Раствор карбоната натрия может взаимодействовать
2) Fe
3) K2SiO3
4) CaCl2
Изучи теорию!
Слайд 41Химические свойства солей
1.Соль 1 +кислота 1 =соль 2 + кислота 2
HNO3, H2SO4, HCl,H3PO4, H2SO3, H2CO3, H2S, H2SiO3
(Каждая предыдущая кислота вытесняет из соли последующую)
2.Соль 1 + щелочь = соль 2 + Ме(ОН)n
3.Соль 1(Р) + соль 2(Р) = соль 3 + соль 4
4.Соль1(Р) + металл 1 = соль 2 + металл 2
5.Разложение некоторых солей при нагревании
Li K Ba Sr Ca Na Mg Al Zn Cr Fe Cd Co Ni Sn Pb (H2) Cu Hg Ag Pt Au
Металл, стоящий левее, вытесняет металл, стоящий правее из их солей в растворе (исключения- Li K Ba Sr Ca Na )
Слайд 42А 13
Верны ли следующие суждения о правилах безопасного обращения с веществами
А.При работе с жидкими чистящими препаратами для ванн и раковин рекомендуется использовать резиновые перчатки.
Б.Столовый уксус должен храниться вместе с препаратами бытовой химии.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Подумай!
Слайд 43А14.
Азот является окислителем в реакции
2) 3CuO +2NH3 = N2+ 3Cu +3H2O
3) 4NH3 + 5O2 = 4NO + 6H2O
4) 6Li + N2 = 2Li3N
Изучи теорию!
Слайд 44Окислительно-восстановительные реакции
Химические реакции, в результате которых происходит изменение степеней окисления атомов
Восстановление – процесс присоединения электронов атомами, ионами или молекулами (степень окисления понижается).
Атомы, ионы или молекулы, принимающие электроны, называют окислителями.
Окисление – процесс отдачи электронов атомами, ионами или молекулами.
Атомы, ионы или молекулы, отдающие электроны, называют восстановителями.
Cu+2Cl2 + Al0 Al+3Cl3 + Cu0
окислитель
восстановитель
-3е
+2е
восстановление
окисление
Слайд 45А 15.
На какой диаграмме распределение массовых долей элементов соответствует количественному составу
1) 3)
2) 4)
42,1
11,3
Изучи теорию!
Слайд 46Массовая доля элемента
(Э)=
n. Ar (Э)
Mr
n-число атомов
Ar(Э)-относительная масса элемента
Mr-относительная молекулярная масса
Слайд 47Литература
Химия 8,9 класс. О.С. Габриелян. Дрофа. Москва. 2013г.
Неорганическая химия в схемах,
Химия. ГИА-2014. Д.Ю. Добротин, А.А. Каверина. АСТ. Астрель. Москва 2014г.
Химия. Экспресс-курс для поступающих в вузы. А.С. Егоров, Г.Х. Аминова. Ростов-на-Дону. Феникс. 2007г.
Слайд 48Интернет - ресурсы
http://омск104.боусош.рф(Знаешь, значит сдашь. плакат)
http://schools.dnevnik.ru/news.aspx?network=43913&news=505787(Все решают только знания)
http://dist-tutor.pro/course/view.php?id=5&topic=1 (химия, водород,
http://shopfurniture.ru/?ps_category=kofeiniki-i-vse-dlya-kofe&paged=2 (стакан)
http://vsem-darom.ru/products/categories/3199/severodvinsk (шарик)
http://epidems.info/2012/12/08/ (Периодическая таблица)
http://refoteka.ru/r-200178.html(электрохимический ряд напряжений металлов)
http://www.periodictable.ru/about_rus.html(вращающийся кристалл)