- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Обратимость химических реакций. Химическое равновесие и способы его смещения (11 класс)
Содержание
- 1. Презентация по химии Обратимость химических реакций. Химическое равновесие и способы его смещения (11 класс)
- 2. Необратимые химические реакции — это реакции, которые
- 3. Обратимые химические реакции — это реакции, которые
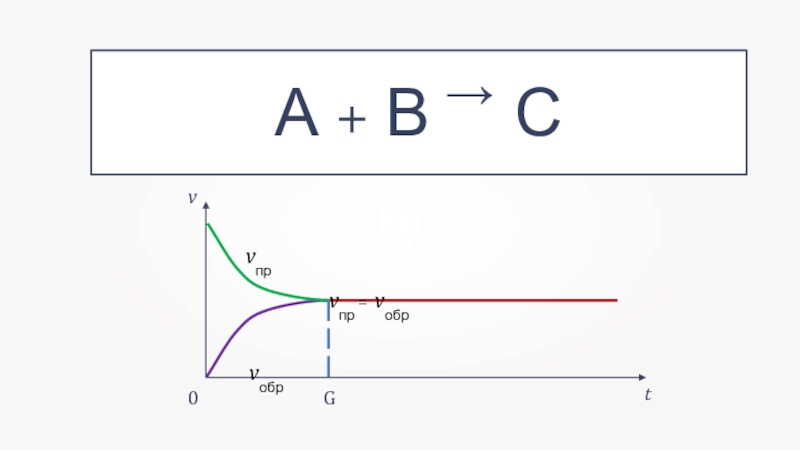
- 4. →А + В → Сtvvпрvпр = vобрvобр0G
- 5. Химическое равновесие — состояние реакционной смеси, при
- 6. Анри Ле Шателье 1850–1936 гг.Закон смещения химического
- 7. Принцип Ле ШательеЕсли изменить одно из условий
- 8. ТемператураКонцентрациявеществДавлениеФакторы, влияющие на смещение химическогоравновесия
- 9. При повышении температуры система противодействует, т.е. охлаждает
- 10. При понижении температуры система отвечает нагреванием, т.е.
- 11. Чтобы увеличить скорость прямой реакции, нужно понизитьдавление
- 12. При увеличении концентрации NO2 скорость прямой реакции
Слайд 2Необратимые химические реакции — это реакции, которые протекают только в одном
Слайд 3Обратимые химические реакции — это реакции, которые одновременно протекают в двух
→
СH3COOН + CH3OH → СH3COOCН3 + H2O
Уксусная кислота
H+
Метиловый Метилацетат спирт
Слайд 5Химическое равновесие — состояние реакционной смеси, при котором прямая и обратная
v
t
vпр
vобр
vпр = vобр
0
G
Химическое равновесие
Слайд 6Анри Ле Шателье 1850–1936 гг.
Закон смещения химического равновесия в зависимости от
Фердинанд Браун 1850–1918 гг.
Слайд 7Принцип Ле Шателье
Если изменить одно из условий (температуру, давление или концентрацию
Слайд 9При повышении температуры система противодействует, т.е. охлаждает себя, что происходит за
1. Изменение температуры
→
2NO2 → 2NO + O2 - Q
Эндотермическая
реакция
Экзотермическая реакция
Слайд 10При понижении температуры система отвечает нагреванием, т.е. смещением равновесия в сторону
1. Изменение температуры
→
2NO2 → 2NO + O2 - Q
Эндотермическая
реакция
Экзотермическая реакция
Слайд 11Чтобы увеличить скорость прямой реакции, нужно понизить
давление в сосуде.
Чтобы сместить равновесие
2. Изменение давления
→
2NO2 → 2NO + O2 - Q
Слайд 12При увеличении концентрации NO2 скорость прямой реакции увеличится. Если увеличить концентрацию
3. Изменение концентрации веществ
→
2NO2 → 2NO + O2 - Q