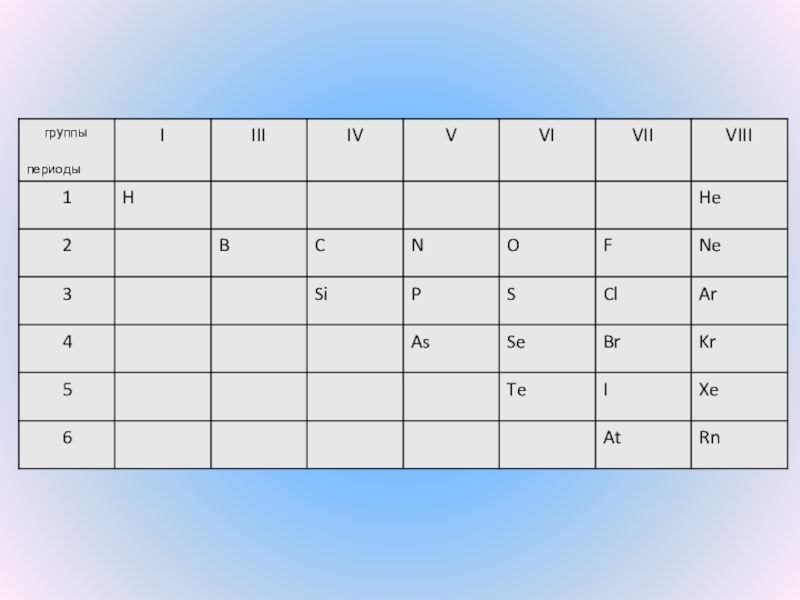
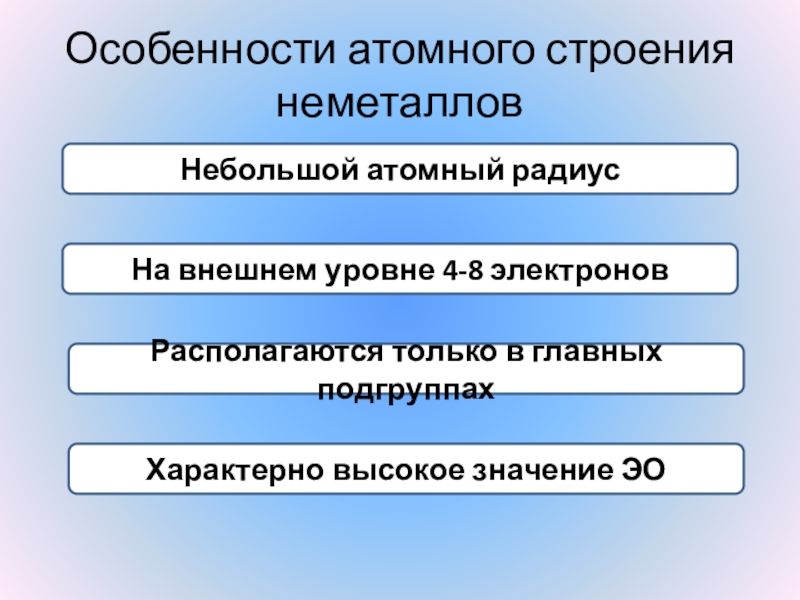
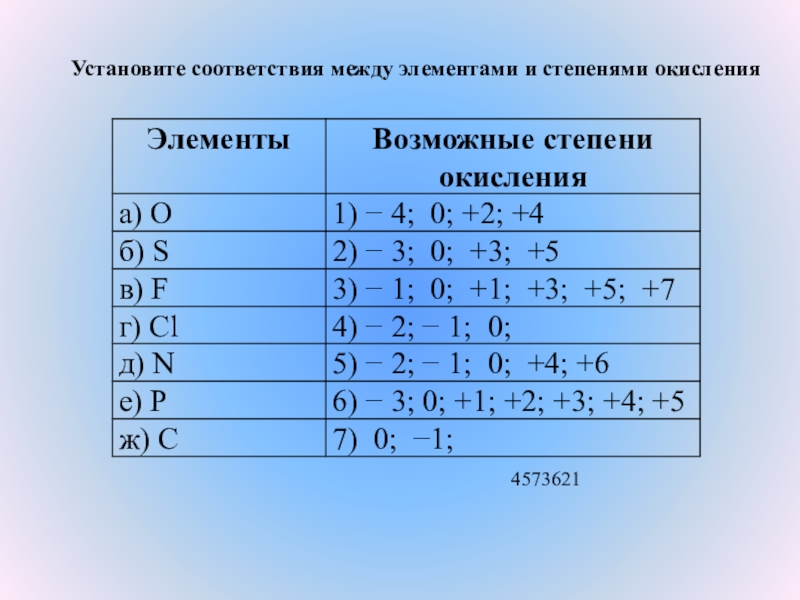
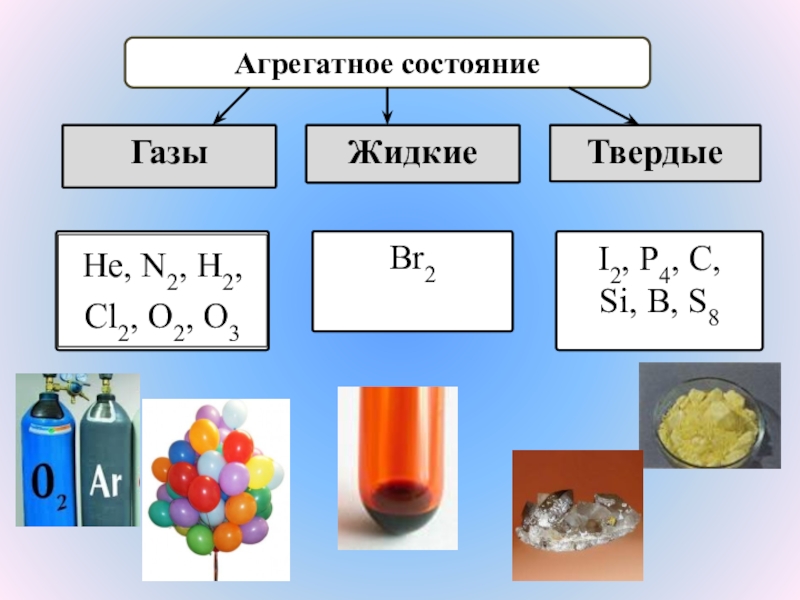
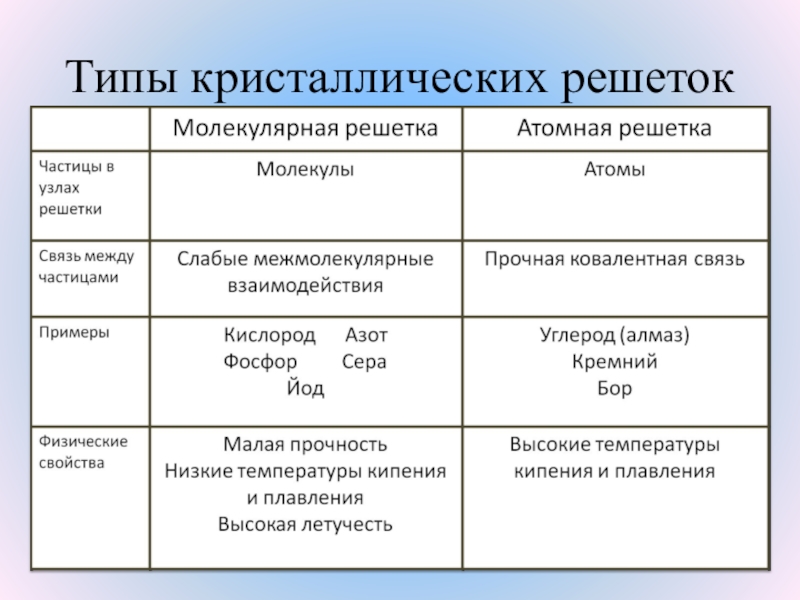
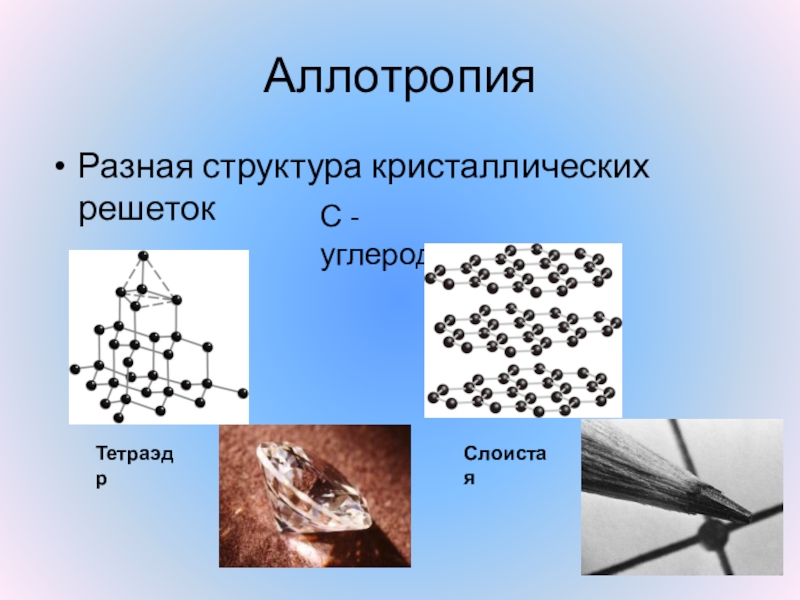
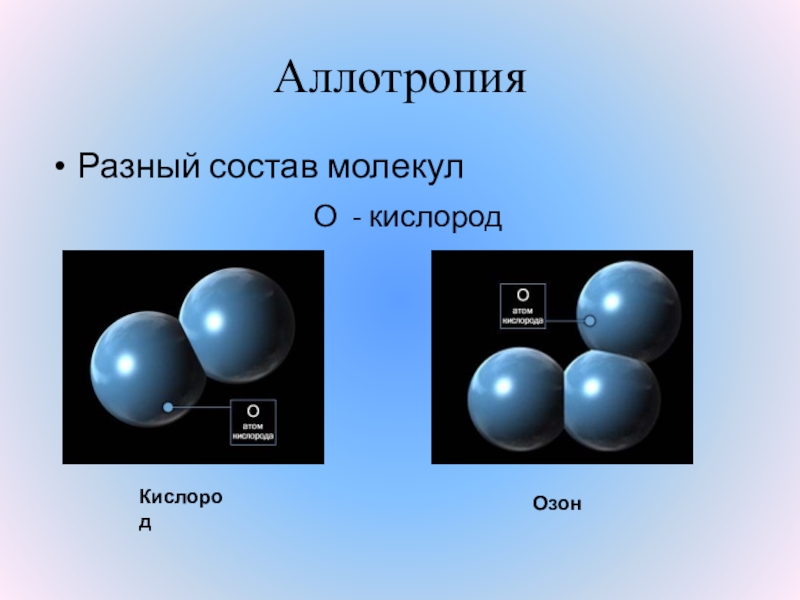
КИСЛОРОДА
В воздухе он главный газ,
Окружает всюду нас.
Угасает жизнь растений
Без него, без удобрений.
В наших клеточках живет
Важный элемент …
АЗОТ
Удивить готов он нас -
Он и уголь, и алмаз,
Он в карандашах сидит,
Потому что он — графит.
Грамотный народ поймет
То, что это …
УГЛЕРОД