- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему:Вода-самое удивительное вещество
Содержание
- 1. Презентация по химии на тему:Вода-самое удивительное вещество
- 2. Воде была дана волшебная власть стать соком жизни на Земле.Леонардо да Винчи.
- 3. Вода в природе.Организмы животных и растений содержат
- 4. Строение молекулы водыМолекула воды имеет угловое строение,
- 5. Водородные связи.Молекула воды – устойчивое химическое соединение,
- 6. Слайд 6
- 7. Некоторые физические свойства воды являются аномальными.
- 8. Физические свойства воды Вода (оксид водорода) при
- 9. Максимальная плотность воды при 4 ºС. При
- 10. Слайд 10
- 11. ЭлектропроводностьСовершенно чистая вода плохо проводит электрический ток.
- 12. Химические свойства воды. Запишите реакции, с помощью
- 13. Вода — лучший растворитель в мире! Она
- 14. Вода – универсальный растворительВода – универсальный растворитель.
- 15. Вода – самое необыкновенное вещество в мире.вода
- 16. Значение водыРазгадайте кроссворд. В нем тема нашего
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. В Москве самый высокий уровень водопотребления
- 24. Ежегодное потребление воды в расчете на одного
- 25. Слайд 25
- 26. Пословицы о воде:1. Где вода, там жизнь.2. Вода – кровь земли.
- 27. 3. Мать водица – всему царица.4. Много
- 28. Вода — минерал, самый подлинный и удивительный
- 29. У воды очень высокая скрытая теплота плавленияЕсли
- 30. Инструктаж по выполнению домашней работы: 1. Закончите
- 31. Среди всех жидкостей вода имеет
- 32. Берегите воду!
- 33. Слайд 33
Слайд 3
Вода в природе.
Организмы животных и растений содержат от 50 до 90
Установлено, что у новорожденного ребенка вода составляет до 90% массы тела, у взрослого - 70-80%. А критической считается цифра в 55% - именно столько воды содержится в организме человека, умирающего от старости.
Слайд 4Строение молекулы воды
Молекула воды имеет угловое строение, угол между связями
Н-О-Н
Связи О-Н в молекуле воды являются полярными, на атоме кислорода существует частичный отрицательный заряд, на атомах водорода – частичный положительный заряд.
В целом молекула воды является полярной молекулой, т. е. диполем: + -
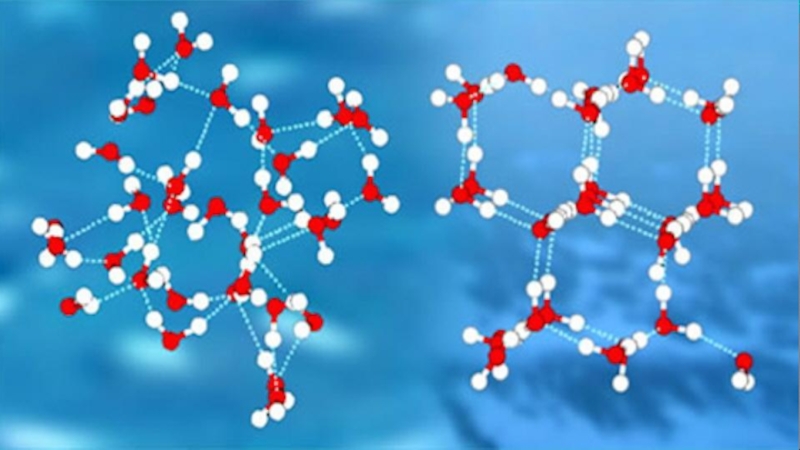
Слайд 5Водородные связи.
Молекула воды – устойчивое химическое соединение, т. к. для воды
Слайд 7Некоторые физические свойства воды являются аномальными.
Вода является единственным на
Слайд 8Физические свойства воды
Вода (оксид водорода) при обычных условиях – прозрачная
Практически все тела при нагревании расширяются, при охлаждении сжимаются. В интервале температур от +4 до 0С вода при охлаждении расширяется! Наибольшую плотность (1000 кг/м) вода имеет при +4 С, при более низкой и более высокой температурах плотность воды несколько меньше.
Вопрос: Что такое «синий уголь?»
Ответ: ВОДА
Слайд 9Максимальная плотность воды при 4 ºС. При замерзании вода расширяется. Лёд
Температура замерзания воды
Температура кипения воды
0 ºС
+100 ºС
Слайд 10 У воды
Слайд 11Электропроводность
Совершенно чистая вода плохо проводит электрический ток. По тому, как проводит
Слайд 12Химические свойства воды.
Запишите реакции, с помощью которых можно осуществить следующие превращения:
HCl → H2 → H2O → NaOH
H2CO3
Ответы:
1. Ca + 2HCl = CaCl2 + H2↑
2. 2H2 + O2 = 2H2O
3. 2Na + 2H2O = 2NaOH + H2↑
4. H2O + CO2 ↔ H2CO3
вода – одно из наиболее реакционноспособных веществ.
1.Вода при обычных условиях взаимодействует с такими сильнейшими восстановителями, как щелочные и щелочноземельные металлы:
2 Na + 2H2O= 2NaOH+ H2
2. Многие химические процессы ускоряются в присутствии воды, т. е. вода играет роль катализатора:
2AL + 3I2==== 2 ALI3
3. Взаимодействие с основными оксидами (оксидами металлов):
CaO + H2O = Ca(OH)2
Взаимодействие с кислотными оксидами (оксидами неметаллов):
SO3+ H2O = H2SO3
5. Для воды характерна реакция разложения, ее еще называют электролизом воды. Она протекает под действием электрического тока в специальном устройстве – электролизёре. В результате образуется два газа – кислород и водород. 2 H2O === 2H2 + O2
Слайд 13Вода — лучший растворитель в мире! Она растворяет очень многие вещества,
Благодаря этому качеству вода смогла стать носителем жизни.
Слайд 14Вода – универсальный растворитель
Вода – универсальный растворитель. На дне Тихого океана
Вода широко используется в качестве растворителя в химической технологии, а также в лабораторной практике. Она представляет собой универсальный растворитель, необходимый для протекания биохимических реакций. Вода прекрасно растворяет ионные, а также многие ковалентные соединения. Способность воды хорошо растворять многие вещества, обусловлена полярностью ее молекул. Молекула воды обладает сравнительно большим дипольным моментом. Поэтому при растворении в ней ионных веществ молекулы воды ориентируются вокруг ионов – гидратируют их. Водные растворы ионных веществ являются электролитами. Обучающиеся проводят опыты.
Слайд 15Вода – самое необыкновенное вещество в мире.
вода у древних химиков считалась
Водные источники у древних народов служили местом сборища, воде поклонялись как сверхъестественной силе, и она считалась матерью жизни и смерти.
Основатель греческой медицины Гиппократ, живший в 4 веке до нашей эры, при лечении на одно из первых мест ставил воду (основное средство гигиены).
В составе мантии Земли воды содержится в 10 – 12 раз больше, чем в Мировом океане.
В среднем соленость Мирового океана составляет около 3,5%. Наименее соленой является вода Финского залива и северной части Ботнического залива, входящих в акваторию Балтийского моря. Наиболее соленой является вода Красного моря.
Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде.
Вода отражает 5% солнечных лучей, в то время как снег – около 85%, под лед океана проникает лишь 2% солнечного света.
«Где вода, там и жизнь» и «Земля умирает, если ушла вода» - эти восточные пословицы известны каждому.
Слайд 16Значение воды
Разгадайте кроссворд. В нем тема нашего занятия является ключевым словом.
По горизонтали. 1. Класс неорганических соединений. 2. Газ, необходимый для дыхания.
3. Общее название солей соляной кислоты. 4. Неметалл желтого цвета.
По вертикали – ключевое слово.
Ответы на кроссворд
1. Основания. 2. Кислород. 3. Хлориды. 4. Сера. Ключевое слово: ВОДА
Слайд 23 В Москве самый высокий уровень водопотребления до 700 литров, в
Слайд 24
Ежегодное потребление воды в расчете на одного жителя Земли составляет 7-
Слайд 273. Мать водица – всему царица.
4. Много воды, много травы.
5. Много
6. Пей воду, вода не смутит ума.
Слайд 29У воды очень высокая скрытая теплота плавления
Если бы у воды не
Слайд 30Инструктаж по выполнению домашней работы:
1. Закончите уравнения химических реакций, укажите
а) SO2 + H2O →;
б) Ca + H2O →;
в) H2O + P2O5 →;
г) Na + H2O →;
д) BaO + H2O →;
е) K2O + H2O →;
ж) Al2S3 + H2O →.
2. п. 6 стр. 47-53; упр. 2 и п. 17 стр. 143-149; упр. 1; 4
3. Пофантазируйте и продолжите рассказ: «Если бы я стал(а) капелькой воды, то…»
Можно составить рассказ о путешествии капельки воды в природе.