- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему:Теория электролитической диссоциации(10 класс)
Содержание
- 1. Презентация по химии на тему:Теория электролитической диссоциации(10 класс)
- 2. I.А Самостоятельная работаЗадача №1. Рассчитайте массу сахара
- 3. «Мышление начинается с проблемной ситуации» С. Л. РубинштейнДевиз урока:
- 4. Жил один кристалл ионный,Для ионов дом огромный,Был
- 5. «Теория электролитической диссоциации (ТЭД)»Тема урока :19.04.2015
- 6. Давать определение понятиям: электролит, неэлектролит,
- 7. Что такое электрический ток ?Электрический ток –
- 8. Задание № 3.Видео вопрос: Какие вещества проводят
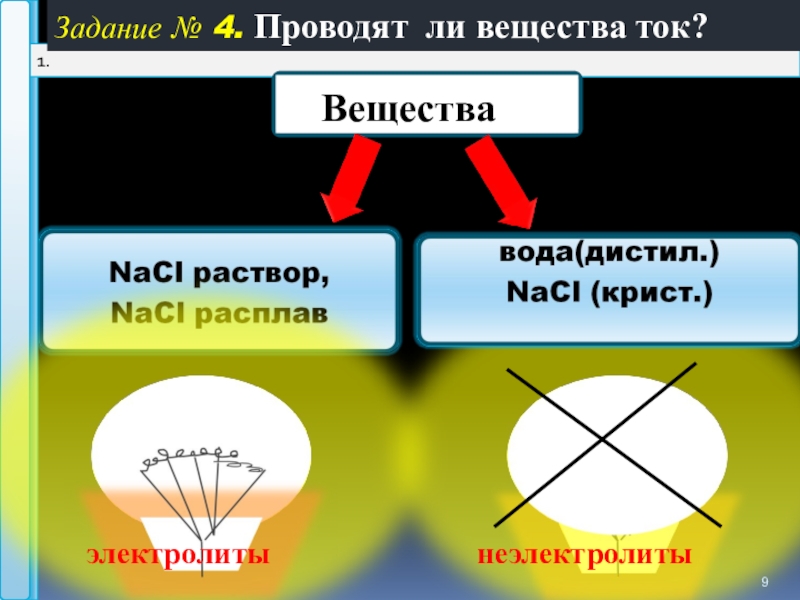
- 9. 1 1. Задание № 4. Проводят ли вещества ток?электролитынеэлектролиты
- 10. Задание № 5. «Перепутанные фразы» Составьте определение
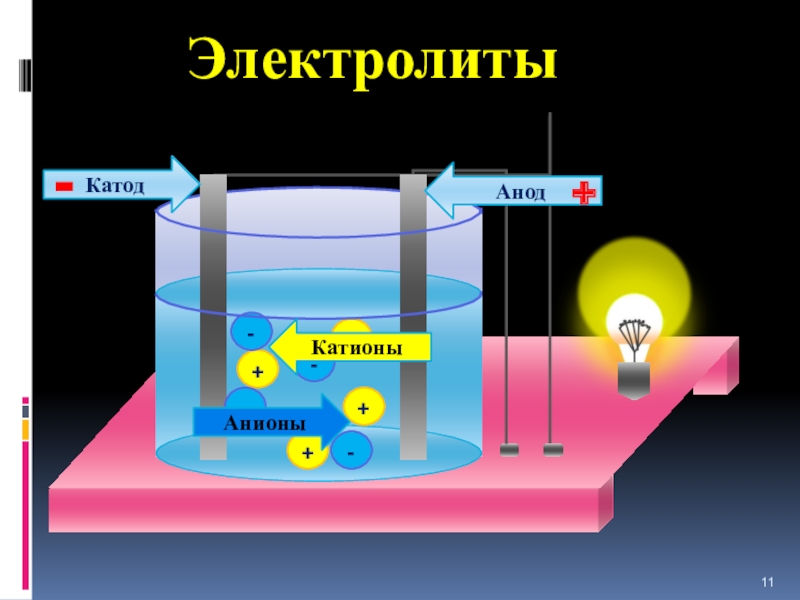
- 11. ++++----АнионыКатионыАнодКатод-+Электролиты
- 12. Задание № 6. Используя таблицу растворимости приведите примеры электролитов (по одной формуле).Кислоты: …Щелочи: …Соли: …
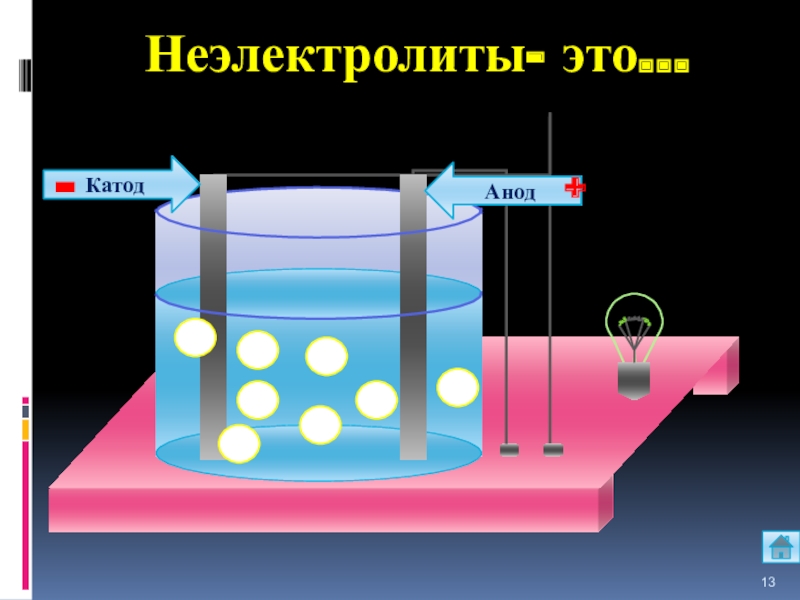
- 13. АнодКатод-+Неэлектролиты- это…
- 14. Неэлектролиты-это вещества, растворы или расплавы которых не проводят эл.ток.Задание № 7. «Дай мне название»
- 15. Задание № 8. Используя таблицу растворимости приведите примеры 2 неэлектролитов.
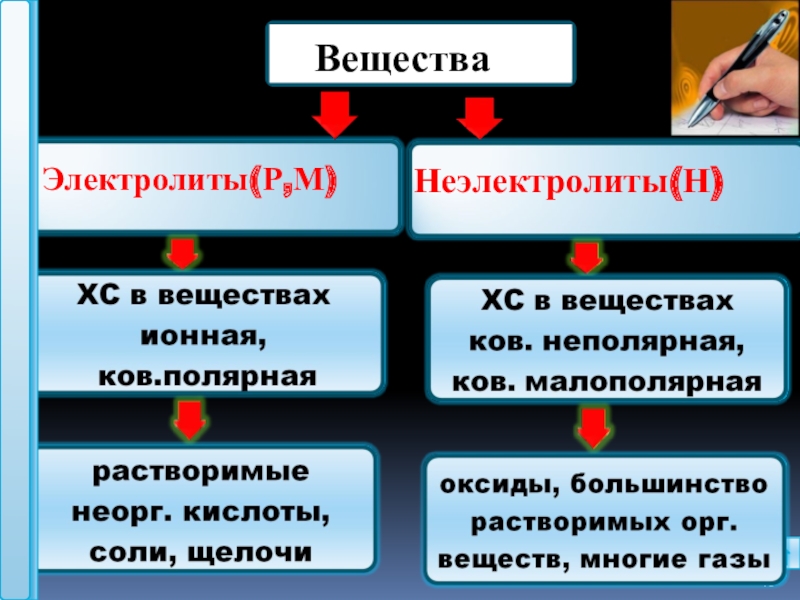
- 16. Электролиты(Р,М)Неэлектролиты(Н)
- 17. процесс распада молекул электролита на ионы в
- 18. Аррениус Сванте Август Шведский ученый, академик.В 1887
- 19. NaCl = Na+ + Cl-CaCl2 = Ca2 + + 2Cl-
- 20. Задание № 9. Какие заряженные частицы -
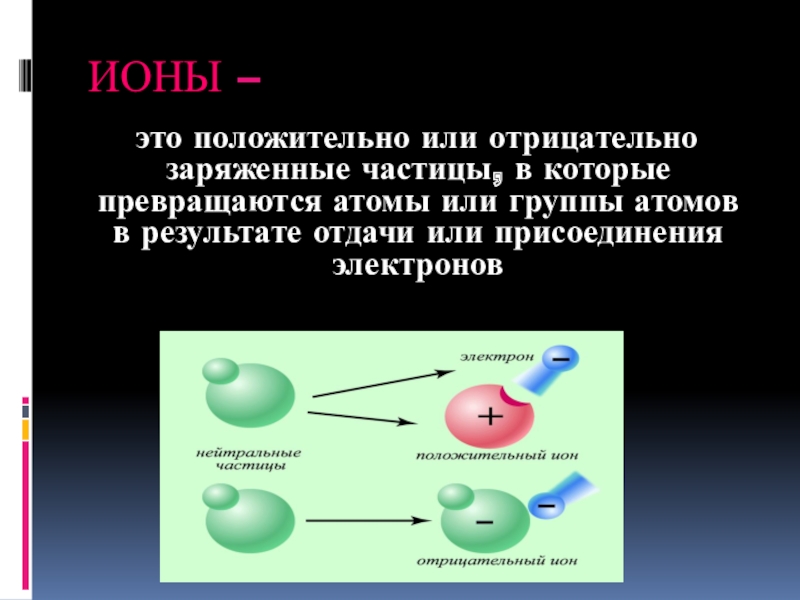
- 21. это положительно или отрицательно заряженные
- 22. Натрия
- 23. Классификация ионов
- 24. Задание № 10. Задания к I-му положению
- 25. 2 положение: Причиной диссоциации электролита является его
- 26. «Капля воды и камень точит»хороший растворительи молекула воды полярна. Вода – 2.Электролиты и неэлектролиты
- 27. РастворNaCl = Na+ + Cl - ЭД веществ с ионной связью(NaCl)Гидратированные ионыH2O3.Механизм ЭД
- 28. РастворHCl = H+ + Cl - ЭД в-в с ковалентной полярной связью (HCl)Гидратированные ионыH2O4.Механизм ЭДHCl
- 29. Вывод: Механизм ЭД: Веществ с ионной связью:1.Ориентация
- 30. Задание № 11. Задания ко II-му положению
- 31. 3 положение. Под действием электрического тока положительно
- 32. 4 положение. Процесс диссоциации- обратимый процесс для
- 33. Задание № 12. Укажите процессы описанные в
- 34. Ребята, берегите зрение!Ребята, берегите зрение!
- 35. HCl+++Сильные и слабые электролитыОт чего зависит сила
- 36. отношение числа продиссоциированных молекул к общему числу
- 37. Электролиты1.Сильные и слабые электролиты (!!!ТР)
- 38. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов)КИСЛОТЫ
- 39. Слайд 39
- 40. Многоосновные кислоты диссоциируют ступенчатоH3PO4 (фосфорная кислота)1) Образование
- 41. Задание №13. Напишите уравнения диссоциации следующих
- 42. Многокислотные основания диссоциируют ступенчатоCa(OH)2 (гидроксид кальция)1) Образование
- 43. K2SO4 = это электролиты, диссоциирующие на катионы
- 44. V.Значение электролитовЭ
- 45. Cимптомы дефицита электролитов в организме человека
- 46. ОшибкаМолодецМолодецОшибкаМолодецМолодецСильные электролитыCa(OH)2ЭлектролитыНеэлектролитыVI.1.Оценочная рефлексия Задание № 15. «Угадай меня»
- 47. VI. 2.Оценочная рефлексия Задание № 16. Тест
- 48. Сравните свои ответы2 3 4 5 B A D A B
- 49. VII.Эмоциональная рефлексия 1.На уроке я работал… 2.Своей
- 50. 1.
- 51. Хоть выйди ты не в белый светА
- 52. МОЛОДЦЫ!Спасибо за сотрудничество
Слайд 2I.А Самостоятельная работа
Задача №1. Рассчитайте массу сахара и объем воды которые
Задача №2. Определите массу растворенного вещества, содержащегося в растворе объемом 500 мл с молярной концентрацией КОН 0,1 моль/л.
Задача №3. В какой массе воды нужно растворить 125 г медного купороса СuSО4* 5Н2О, чтобы получить 8% раствор сульфата меди (ll)?
Слайд 4
Жил один кристалл ионный,
Для ионов дом огромный,
Был красивый он и ровный,
Но
Капля на него упала,
И кристалла вмиг не стало:
На ионы распластала
Его ловкая вода.
Все семейство удивилось:
«Что снаружи приключилось?»
Слайд 6Давать определение понятиям:
электролит, неэлектролит, ЭД,
2.Сравнивать вещества по электропроводимости.
3.Различать сильные и слабые электролиты.
4.Рассматривать механизм ЭД.
5.Рассмтривать ЭД кислот, солей и оснований
6.Определять роль электролитов в процессах жизнедеятельности
7.Осуществлять рефлексию своей деятельности
В результате изучения темы, вы будете способны:
Слайд 7Что такое электрический ток ?
Электрический ток – направленное движение
заряженных частиц
Задание
Все ли вещества могут проводить электрический ток ?
II. Задание №1.
Слайд 8Задание № 3.
Видео вопрос: Какие вещества проводят ток , а какие
Слайд 10
Задание № 5. «Перепутанные фразы» Составьте определение используя слова: или ,вещества
I.Электролиты-это вещества, растворы или расплавы которых проводят эл.ток.
Слайд 12Задание № 6. Используя таблицу растворимости приведите примеры электролитов (по одной
Кислоты: …
Щелочи: …
Соли: …
Слайд 14
Неэлектролиты-
это вещества,
растворы или
расплавы которых
не проводят эл.ток.
Задание № 7.
Слайд 17
процесс распада молекул электролита на ионы в растворе или расплаве.
Электролитическая
диссоциация
Теория электролитической диссоциации.
1887 г.
II.Электролитическая диссоциация. ТЭД
С.Аррениус
Слайд 18
Аррениус Сванте
Август
Шведский ученый, академик.
В 1887 году сформулировал основные
В 1903 г. награжден Нобелевской премией.
С.Аррениус
(1859 – 1927)
II.1 Электролитическая диссоциация. ЭД
Слайд 20
Задание № 9. Какие заряженные частицы - ионы вы знаете?
КАТИОНЫ
АНИОНЫ
+
-
Для двух
Взвалил cебе Ион на плечи
Для Кати он несет свой плюс(+)
Для Ани он несет свой минус(-)
Слайд 21 это положительно или отрицательно заряженные частицы, в которые превращаются
ИОНЫ –
Слайд 22
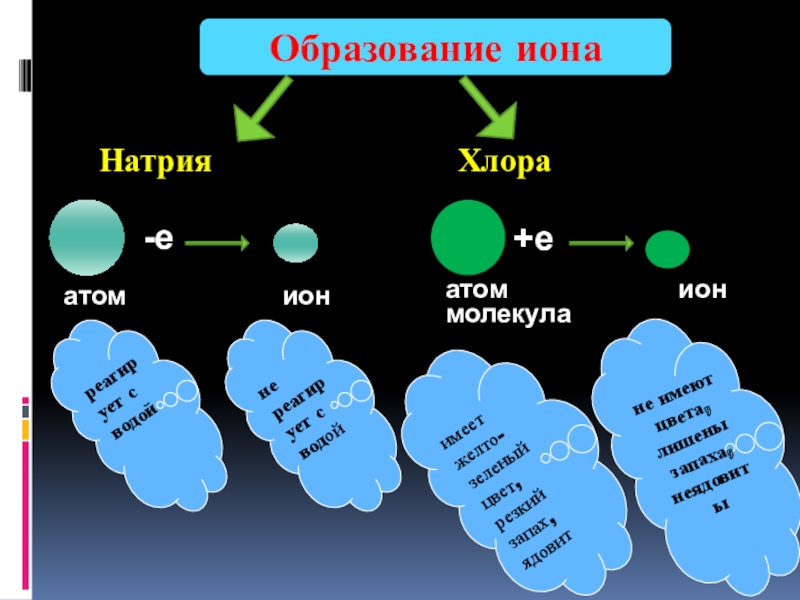
Натрия
-е
атом ион
Образование иона
+е
атом ион
реагирует с водой
имеет желто-зеленый цвет, резкий запах, ядовит
не реагирует с водой
не имеют цвета, лишены запаха, неядовиты
молекула
Слайд 24Задание № 10. Задания к I-му положению ТЭД
1.Какие вещества называются электролитами
2.Назовите по два вещества, которые являются электролитами и неэлектролитами.
3.Укажите вид связи и принадлежность данных веществ к электролитам и неэлектролитам: KCl, O2 , HNO3 ,CuO.
3.Назовите из перечня веществ электролиты (не забудьте воспользоваться таблицей растворимости !): BaCl2 , CaO, H2 SO4 , NaOH, Cl2 , Zn(OH)2
Слайд 252 положение: Причиной диссоциации электролита является его гидратация с молекулами воды
ИОНЫ
(по наличию водной оболочки)
ГИДРАТИРОВАННЫЕ
Например:
В растворах и
кристаллогидратах CuSO4 * 5H2O
Na2SO4* 10H2O
НЕГИДРАТИРОВАННЫЕ
Например:
В безводных солях
Cu2+SO42-
Na+NO3-
Слайд 26
«Капля воды и камень точит»
хороший растворитель
и молекула воды полярна.
Вода –
2.Электролиты и неэлектролиты
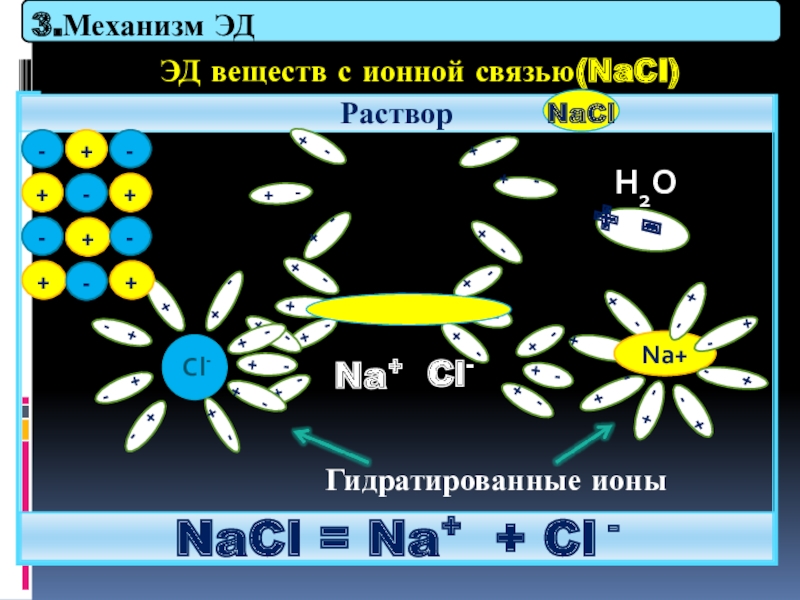
Слайд 27
Раствор
NaCl = Na+ + Cl -
ЭД веществ с ионной связью(NaCl)
Гидратированные
H2O
3.Механизм ЭД
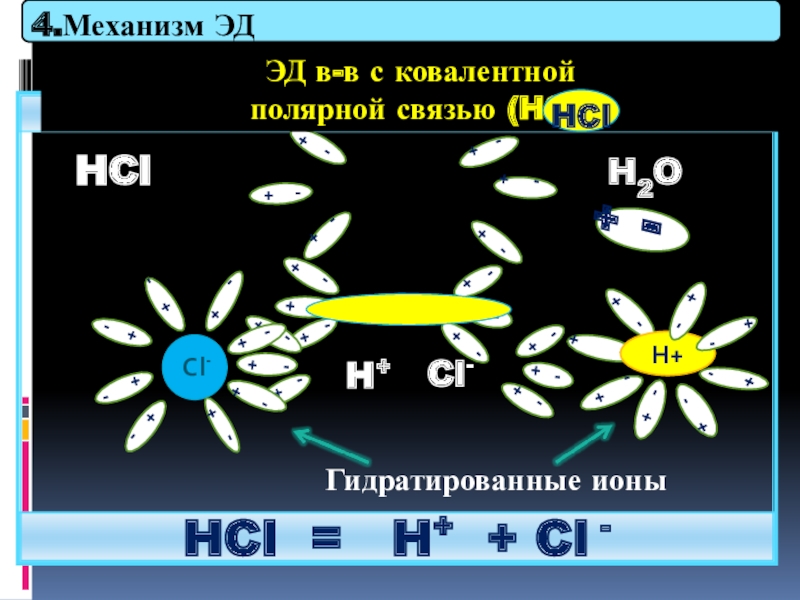
Слайд 28
Раствор
HCl = H+ + Cl -
ЭД в-в с ковалентной
полярной связью (HCl)
Гидратированные ионы
H2O
4.Механизм ЭД
HCl
Слайд 29 Вывод: Механизм ЭД:
Веществ
с ионной связью:
1.Ориентация
диполей воды →
2.гидратация →
3.диссоциация.
Веществ
с ковалентной
связью:
1.Ориентация диполей воды →
2. гидратация→
3.ионизация→
4.диссоциация
Слайд 30Задание № 11. Задания ко II-му положению ТЭД
Сформулируйте второе положение ТЭД.
Что такое электролитическая диссоциация?
Что является причиной ЭД?
Каков механизм ЭД: а)веществ с ионной связью, б) веществ с ковалентной связью?
Назовите частицы: а) H, H2 , H+ ; б) Cl2 , Cl, Cl- .
Назовите катионы и анионы в соединениях, формулы которых: CuCl2 , AgNO3 , Ca(OH)2 , H3 PO4 .
Слайд 31
3 положение. Под действием электрического тока положительно заряженные ионы движутся к
Сумма положительных ионов равна сумме отрицательных ионов, поэтому эти растворы электронейтральны.
NB!
Слайд 324 положение. Процесс диссоциации- обратимый процесс для слабых электролитов
Наряду с процессом
НNО2 Н + + NО2-
Слайд 33Задание № 12. Укажите процессы описанные в этом стихотворении и назовите
Жил один кристалл ионный,
Для ионов дом огромный,
Был красивый он и ровный.
Но случилась с ним беда.
Капля на него упала,
И кристалла вмиг не стало:
На ионы распластала
Его ловкая вода.
Все семейство удивилось:
«Что снаружи приключилось?»
Это рядом появилась вдруг молекул череда,
Подбежали шумным роем,
Окружили плотным строем:
«Предложить хотим героям
нашу дружбу навсегда…»
Водородом к анионам,
Гидроксидом к катионам,
Не уйти от них ионам
Ни туда и ни сюда.
Гидратация
Диссоциация
Слайд 35
HCl
+
+
+
Сильные и слабые электролиты
От чего зависит сила электролита?
5 положение: Не все
Слайд 36
отношение числа продиссоциированных молекул к общему числу молекул, находящихся в растворе.
Степень электролитической
диссоциации (α) -
α =
n
N
NB! Сильные электролиты
α > 30%
NB! Слабые электролиты
α< 30%
Слайд 38ЭЛЕКТРОЛИТЫ
(по характеру образующихся ионов)
КИСЛОТЫ ОСНОВАНИЯ
СОЛИ
6 положение. Химические свойства
Слайд 39
диссоциирующие на катионы H +
и анионы R -
Кислоты -
Нn R → + R n-
Н2SO4 =
IV.1 Кислоты в свете ТЭД
n H+
НCl =
H+ + Cl -
Задание № 11. Напишите уравнения диссоциации следующих кислот:
2 H+ + SO4 2-
р
р
Слайд 40Многоосновные кислоты диссоциируют ступенчато
H3PO4 (фосфорная кислота)
1) Образование дигидрофосфат-ионов
H3PO4 ↔ H+ +
2) Образование гидрофосфат-ионов
H2PO4- ↔ H+ + HPO42-
3) Образование фосфат-ионов
HPO42- ↔ H+ + PO43-
H3PO4 ↔ 3H+ PO43-
Слайд 41Задание №13. Напишите уравнения диссоциации следующих щелочей:
Ca(OH)2 =
это электролиты, диссоциирующие на катионы Ме+ и анионы ОН-
Основания-
Мe(OH)n Men+ n
ОН-
IV.2 Основания в свете ТЭД
K + + OH-
Ca 2+ + 2OH-
р
Ошибка?
Слайд 42Многокислотные основания диссоциируют ступенчато
Ca(OH)2 (гидроксид кальция)
1) Образование гидроксо-ионов кальция
Ca(OH)2 ↔ OH-
2) Образование ионов кальция
CaOH+ ↔ Ca2+ + OH -
Ca(OH)2 ↔ Ca2+ + 2OH -
Слайд 43K2SO4 =
это электролиты,
диссоциирующие
на катионы Ме+ и анионы R-.
Соли-
NaCl =
Al(NO3)3 =
Na+
Al3+
3NO3 -
Сl-
SO 2-4
IV.3 Соли в свете ТЭД
МenRm nMe+ mR
+
Задание №14. Напишите уравнения диссоциации следующих солей:
Ошибка?
+
+
2К+
Слайд 46
Ошибка
Молодец
Молодец
Ошибка
Молодец
Молодец
Сильные электролиты
Ca(OH)2
Электролиты
Неэлектролиты
VI.1.Оценочная рефлексия
Задание № 15. «Угадай меня»
Слайд 47VI. 2.Оценочная рефлексия
Задание № 16. Тест
«Незаконченное предложение»
Электролитическая диссоциация
в растворах – это процесс распада электролита на __________ .
Вопрос 1
Электролитическая диссоциация электролитов в растворах протекает под действием __________ .
Вопрос 2
Слабым электролитом является _______ .
Вопрос 3
Электролитами не являются ________ .
Вопрос 4
Основные положения электролитической диссоциации сформулировал ученый ______.
Вопрос 5
Слайд 49VII.Эмоциональная рефлексия
1.На уроке я работал…
2.Своей работой на уроке я…
3.Урок для меня
активно, доволен, коротким, не устал, полезен, стало лучше, понятен, интересен, легким.
Слайд 501. § 5.6.1 - 2
ДОМАШНЕЕ ЗАДАНИЕ
2. конспект, знать определения
3.Написать уравнения диссоциации 2-4* кислот, щелочей и солей
Слайд 51Хоть выйди ты не в белый свет
А в поле за околицей,-
Пока
Дорога не запомнится.
Зато, куда б ты ни попал
И по какой распутице,
Дорога та, что сам искал,
Вовек не позабудется.
Н.Рыленков