- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Железо (9 класс)
Содержание
- 1. Презентация по химии на тему Железо (9 класс)
- 2. Я ИЗВЕСТЕН С ДАВНИХ ПОР И ИМЕЮ
- 3. Урок по теме: «Железо и его соединения»
- 4. НАХОЖДЕНИЕ В ПРИРОДЕ
- 5. ВЫПИШИТЕ ИЗ УЧЕБНИКА(С. 65) НЕ МЕНЕЕ 4 -Х ФОРМУЛ СОЕДИНЕНИЙ ЖЕЛЕЗА, ВСТРЕЧАЮЩИХСЯ В ПРИРОДЕ.
- 6. гематит Fe2O3 – содержит до 65%железа, месторождения
- 7. Правильный ответ1, 2, 4, 5, 7, 9,
- 8. Визитка химического элемента
- 9. Охарактеризуйте Fe как химический элемент, составив предложения
- 10. )Порядковый № 26, 4 период , VIII
- 11. FеСl3, FеSО4, Fе(ОН)2, Fе(ОН)3, Fе2(SО4)3, FеВr2ОПРЕДЕЛИТЕ СТЕПЕНИ ОКИСЛЕНИЯ ЖЕЛЕЗА В СОЕДИНЕНИЯХ:
- 12. ПРОВЕРЬ СЕБЯ! Fе+3Сl3, Fе+2SО4, Fе+2(ОН)2,Fе+3(ОН)3, Fе2+3 (SО4)3, Fе+2Вr2
- 13. ГЕНЕТИЧЕСКИЙ РЯД ЖЕЛЕЗА FЕ2+ FЕSО4→
- 14. FЕ(ОН)2- ЗЕЛЕНЫЙ ОСАДОК ПРОЯВЛЯЕТ ОСНОВНЫЕ СВОЙСТВАFеSО4+
- 15. ГЕНЕТИЧЕСКИЙ РЯД ЖЕЛЕЗА FЕ3+ FЕCL3→ FЕ(ОН)3
- 16. FЕ(ОН)3- БУРЫЙ ОСАДОК ПРОЯВЛЯЕТ АМФОТЕРНЫЕ СВОЙСТВАFЕСL3+ 3NAOH=3NAСL
- 17. ХИМИЧЕСКИЕ СВОЙСТВА
- 18. НАЙДИТЕ СООТВЕТСТВИЕ МЕЖДУ РЕАГЕНТАМИ И ПРОДУКТАМИ:
- 19. Fe + Cl2→ FeCl3
- 20. РОЛЬ ЖЕЛЕЗА В ЖИЗНЕДЕЯТЕЛЬНОСТИ ЖИВЫХ ОРГАНИЗМОВЖелезо входит
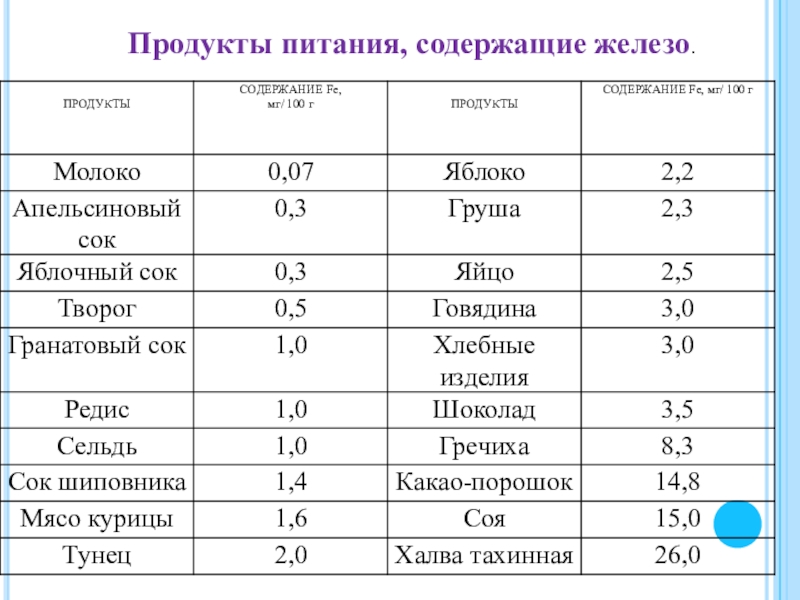
- 21. Продукты питания, содержащие железо.
- 22. Железо - самый употребляемый металл, на него
- 23. ИТОГ УРОКА: - Я УЗНАЛ…
- 24. ДОМАШНЕЕ ЗАДАНИЕ:1 уровень - с. 68 упр.
Слайд 1УРОК ХИМИИ
9 КЛАСС
ТЕМА: ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЯ
Автор: Казакова Людмила Васильевна
МКОУ «Пудемская средняя общеобразовательная школа»
Слайд 2Я ИЗВЕСТЕН С ДАВНИХ ПОР И ИМЕЮ СПРОС, ОПУСТИ МЕНЯ В РАСТВОР
Железо
Слайд 5
ВЫПИШИТЕ ИЗ УЧЕБНИКА
(С. 65)
НЕ МЕНЕЕ 4 -Х ФОРМУЛ СОЕДИНЕНИЙ
ЖЕЛЕЗА, ВСТРЕЧАЮЩИХСЯ
Слайд 6гематит Fe2O3 – содержит до 65%железа,
месторождения встречаются в Криворожском районе
лимонит
месторождения встречаются в Крыму (Керченское месторождение)
Магнетит Fe3O4 – содержит 72% железа, месторождения встречаются на Южном Урале, КМА
Известно большое число минералов, в состав которых входит железо: магнетит (магнитный железняк) — Fe3O4, гематит (красный железняк) — Fe2O3, железный шпат (сидерит) — FeCO3, железный колчедан(пирит) — FeS2, лимонит - Fe2O3-nН2Ои др.
Слайд 7Правильный ответ
1, 2, 4, 5, 7, 9, 10
ВЫБЕРИТЕ И ЗАПИШИТЕ ЦИФРЫ
1. МЕТАЛЛИЧЕСКИЙ БЛЕСК
2. СЕРЕБРИСТО-БЕЛЫЙ МЕТАЛЛ
3. САМЫЙ ТВЁРДЫЙ МЕТАЛЛ
4. TТЕМПЕРАТУРА ПЛАВЛЕНИЯ +1539ОС
5. ПЛАСТИЧНЫЙ
6. ЛЕГКО РЕЖЕТСЯ НОЖОМ
7. ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК
8. ЛЁГКИЙ
9.ПРОВОДИТ ТЕПЛО
10. ЛЕГКО НАМАГНИЧИВАЕТСЯ И РАЗМАГНИЧИВАЕТСЯ
Слайд 9Охарактеризуйте Fe как химический элемент, составив предложения со словами и словосочетаниями:
Порядковый
Заряд ядра, распределение электронов по уровням
Электронная формула внешнего уровня
Степень окисления
Слайд 10
)
Порядковый № 26, 4 период , VIII группа побочная подгруппа
Заряд ядра
электронов 2 8 14 2
1s22s22p63s23p64s2 3d6
(относится к d- элементам
+2, + 3
Слайд 11FеСl3, FеSО4, Fе(ОН)2, Fе(ОН)3, Fе2(SО4)3, FеВr2
ОПРЕДЕЛИТЕ СТЕПЕНИ ОКИСЛЕНИЯ ЖЕЛЕЗА В СОЕДИНЕНИЯХ:
Слайд 13
ГЕНЕТИЧЕСКИЙ РЯД ЖЕЛЕЗА FЕ2+
FЕSО4→ FЕ (ОН)2 → FЕО
Получение Fе(ОН)2
Цель: получить гидроксид железа (II) и охарактеризовать его.
В чистую пробирку прилить 1-2 мл раствора соли FеSО4, добавить щелочь NaOH. Что наблюдаете?
Рассмотреть реакцию с точки зрения ТЭД
СОБЛЮДАЙТЕ ПТБ!
Слайд 14
FЕ(ОН)2- ЗЕЛЕНЫЙ ОСАДОК
ПРОЯВЛЯЕТ ОСНОВНЫЕ СВОЙСТВА
FеSО4+ 2NaOH=Na2SО4+ Fе(ОН)2↓
Fе2++SО42-+ 2Na++2OH- =2Na++SО42-+Fе(ОН)2
Fе2++ 2OH-
Fе(ОН)2 = FеО +Н2О
FеО- основный оксид
Слайд 15
ГЕНЕТИЧЕСКИЙ РЯД ЖЕЛЕЗА FЕ3+
FЕCL3→ FЕ(ОН)3 → FЕ2О3
Получение Fе(ОН)3
Цель: получить гидроксид
В чистую пробирку прилить 1-2 мл. раствора соли FеСl3, добавить щелочь NaOH. Что наблюдаете?
Рассмотреть реакцию с точки зрения ТЭД.
СОБЛЮДАЙТЕ ПТБ!
Слайд 16
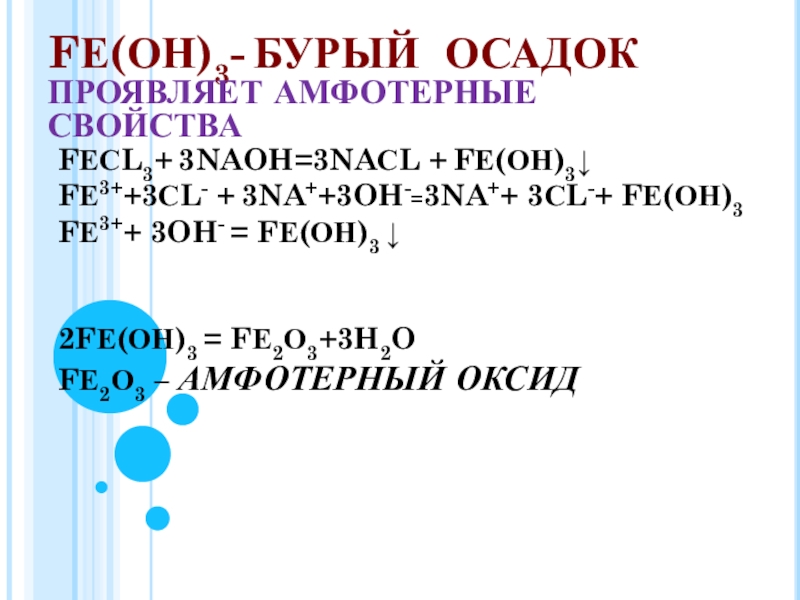
FЕ(ОН)3- БУРЫЙ ОСАДОК
ПРОЯВЛЯЕТ АМФОТЕРНЫЕ СВОЙСТВА
FЕСL3+ 3NAOH=3NAСL + FЕ(ОН)3↓
FЕ3++3СL- + 3NA++3OH-=3NA++ 3СL-+
Слайд 19
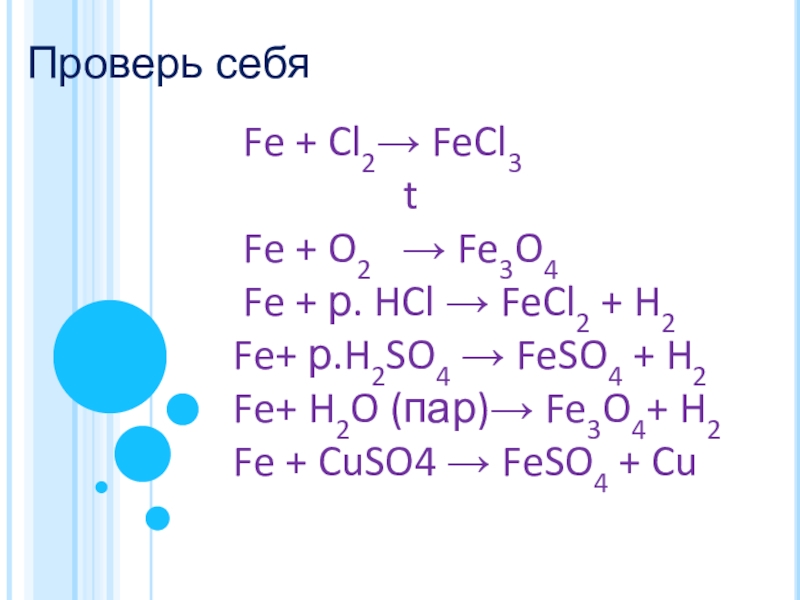
Fe + Cl2→ FeCl3
Fe + O2 → Fe3O4
Fe + р. HCl → FeCl2 + H2
Fe+ р.H2SO4 → FeSO4 + H2
Fe+ H2O (пар)→ Fe3O4+ H2
Fe + CuSO4 → FeSO4 + Cu
Проверь себя
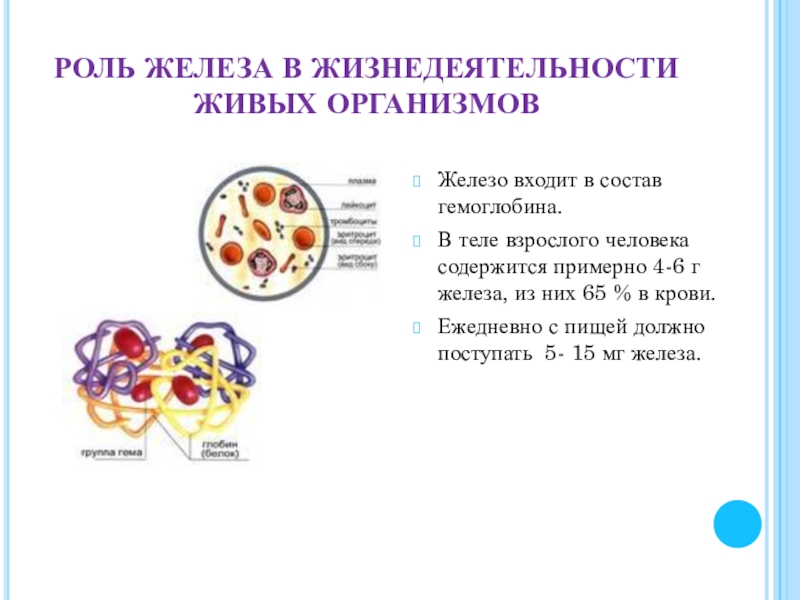
Слайд 20РОЛЬ ЖЕЛЕЗА В ЖИЗНЕДЕЯТЕЛЬНОСТИ ЖИВЫХ ОРГАНИЗМОВ
Железо входит в состав гемоглобина.
В
Ежедневно с пищей должно поступать 5- 15 мг железа.
Слайд 22
Железо - самый употребляемый металл, на него приходится до 90 %
Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления трансформаторов, электромоторов и мембран микрофонов.
Основная масса железа на практике используется в виде сплавов – чугуна и стали.