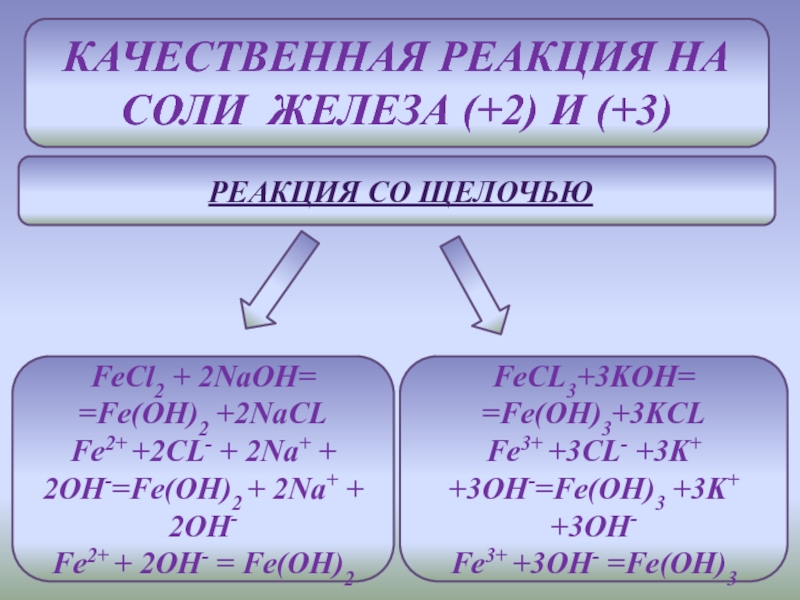
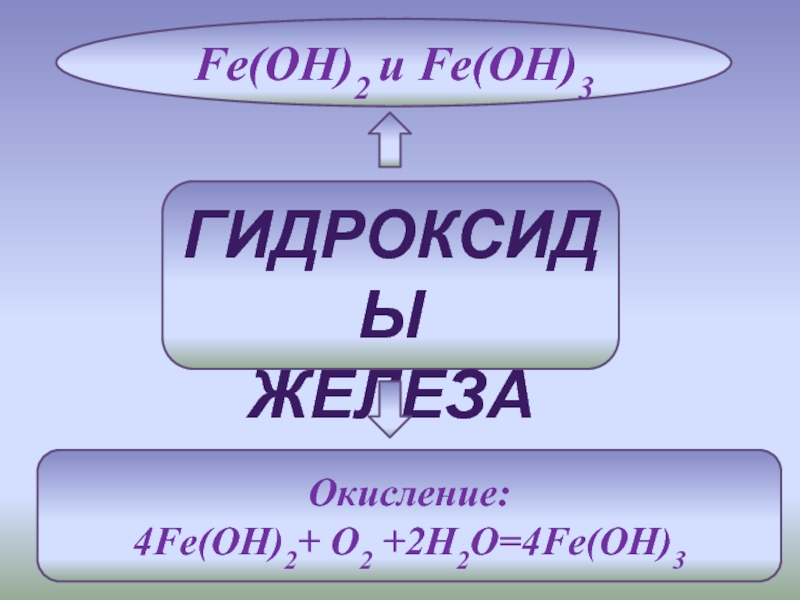
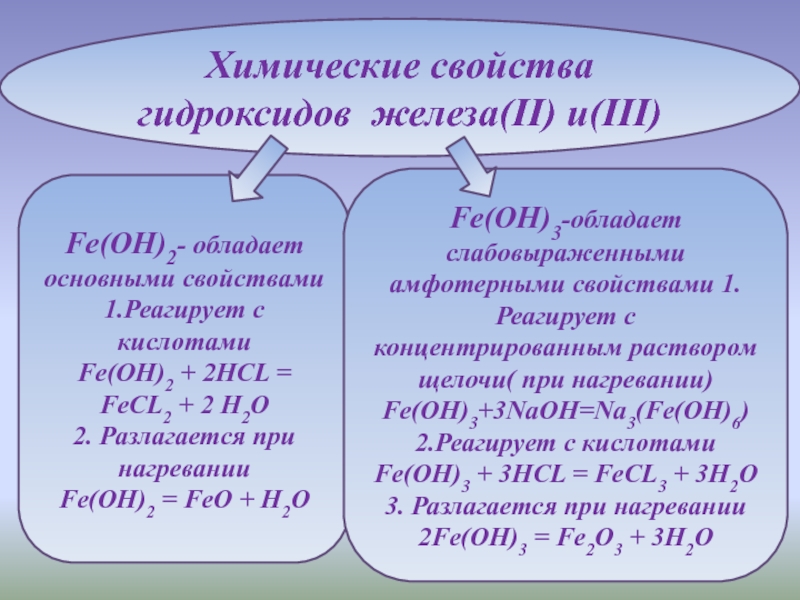
С - Б - неметаллов
2.Сколько электронов содержится на внешних
энергетических уровнях атомов металлов :
А - от 3 до 8 О -
3.Системы состоящие из нескольких
твердых компонентов:
Г - аэрозоли Е -
4.В периоде с увеличением атомной массы металлические свойства:
К- увеличиваются Д-
металлов
от 1 до 3
о
сплавы
е
уменьшаются
д и