- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Железо
Содержание
- 1. Презентация по химии на тему Железо
- 2. СТРАНИЦЫ ИСТОРИИВ древности у некоторых народов железо
- 3. FeЖелезный или серный колчедан (пирит)FeS2 Красный железнякГематит
- 4. Железо – один из наиболее распространенных на
- 5. ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТЖЕЛЕЗО (лат. Ferrum), Fe,
- 6. ФИЗИЧЕСКИЕ СВОЙСТВАЖелезо – блестящий серебристо-белый пластичный металл
- 7. ХИМИЧЕСКИЕ СВОЙСТВА В реакциях железо является
- 8. ХИМИЧЕСКИЕ СВОЙСТВАПри очень высокой температуре железо реагирует
- 9. При высокой температуре раскаленное железо реагирует с
- 10. ХИМИЧЕСКИЕ СВОЙСТВАПри нагревании концентрированная H2SO4 окисляет железо
- 11. ХИМИЧЕСКИЕ СВОЙСТВА Из растворов солей железо
- 12. СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙ) Оксид железа
- 13. СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙ) Гидроксид железа (II)
- 14. СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙ) Так, свежеполученный осадок
- 15. СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙΙ) Оксид железа (III)
- 16. СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙΙ) Соединения со степенью
- 17. СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙΙ)Образуется темно-синий осадок – берлинская
- 18. ЖЕЛЕЗО И ПИЩАЖелезо поступает в организм с
- 19. ЖЕЛЕЗО И ПИЩАМногие мучные продукты витаминизированы железом.
- 20. Содержание железа в продуктах питания (на 100
- 21. СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ1. Габриелян, О.С. Химия. 9
СТРАНИЦЫ ИСТОРИИВ древности у некоторых народов железо ценилось дороже золота. В Древнем Риме из железа изготовляли даже обручальные кольца.В географии» древнегреческого писателя Страбона упоминается о том, что африканские народы за один фунт железа отдавали десять фунтов
Слайд 1ЖЕЛЕЗО
ОГАПОУ «Белгородский техникум промышленности и сферы услуг
Лопанова Е.В.,
преподаватель химии
г. Белгород,
2015
Слайд 2СТРАНИЦЫ ИСТОРИИ
В древности у некоторых народов железо ценилось дороже золота.
В
Древнем Риме из железа изготовляли даже обручальные кольца.
В географии» древнегреческого писателя Страбона упоминается о том, что африканские народы за один фунт железа отдавали десять фунтов золота.
В географии» древнегреческого писателя Страбона упоминается о том, что африканские народы за один фунт железа отдавали десять фунтов золота.
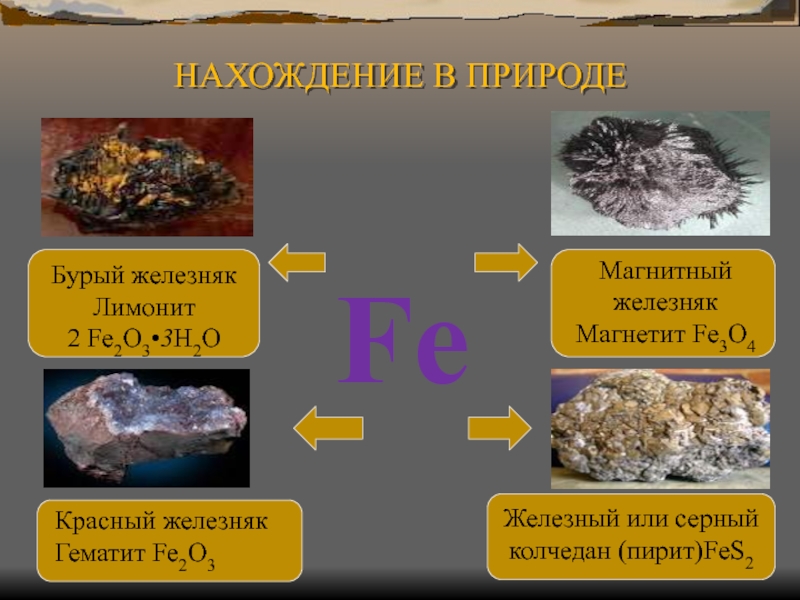
Слайд 3Fe
Железный или серный
колчедан (пирит)FeS2
Красный железняк
Гематит Fe2O3
Бурый железняк
Лимонит
2 Fe2O3•3H2O
Магнитный
железняк
Магнетит Fe3O4
НАХОЖДЕНИЕ В ПРИРОДЕ
Слайд 4Железо – один из наиболее распространенных на Земле элементов: земная кора
содержит около 5% железа, или 755 000 000 000 000 000 тонн. Однако лишь примерно сороковая часть этого количества сконцентрирована в виде месторождений, пригодных для разработки.
Большие запасы железных руд находятся на Урале, где целые горы (например Магнитная, Качканар, Высокая и др.) образованы магнитным железняком. Большие залежи железных руд имеются вблизи Курска, на Кольском полуострове, в Западной и Восточной Сибири, на дальнем Востоке.
Большие запасы железных руд находятся на Урале, где целые горы (например Магнитная, Качканар, Высокая и др.) образованы магнитным железняком. Большие залежи железных руд имеются вблизи Курска, на Кольском полуострове, в Западной и Восточной Сибири, на дальнем Востоке.
Слайд 5ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ
ЖЕЛЕЗО (лат. Ferrum), Fe, химический элемент VIII группы
периодической системы, атомный номер 26, атомная масса 55,847.
Электронная формула 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
Валентные электроны у атома железа находятся на последнем электронном слое (4s2) и предпоследнем (3d6). В химических реакциях железо может отдавать эти электроны и проявлять степени окисления +2, +3 и, иногда, +6.
Электронная формула 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
Валентные электроны у атома железа находятся на последнем электронном слое (4s2) и предпоследнем (3d6). В химических реакциях железо может отдавать эти электроны и проявлять степени окисления +2, +3 и, иногда, +6.
Слайд 6ФИЗИЧЕСКИЕ СВОЙСТВА
Железо – блестящий серебристо-белый пластичный металл , обладает сильными магнитными
свойствами. Легко подвергается ковке, прокатке и другим видам обработки в горячем и холодном состояниях. Физические свойства железа зависят от его чистоты. Т.плавления 1539 , т.кип. около 3200 .
Слайд 7ХИМИЧЕСКИЕ СВОЙСТВА
В реакциях железо является восстановителем. При нагревании становится
активным и реагирует с кислородом, хлором, серой:
3Fe + 2O2 = Fe3O4(FeO Fe2O3)
Оксид железа (II,III)
2Fe + 3Cl2 = 2FeCl3
Хлорид железа (III)
Fe + S = FeS
Сульфид железа (II)
3Fe + 2O2 = Fe3O4(FeO Fe2O3)
Оксид железа (II,III)
2Fe + 3Cl2 = 2FeCl3
Хлорид железа (III)
Fe + S = FeS
Сульфид железа (II)
Слайд 8ХИМИЧЕСКИЕ СВОЙСТВА
При очень высокой температуре железо реагирует с углеродом, кремнием и
фосфором:
3Fe + C = Fe3C
Карбид железа (цементит)
3Fe + Si = Fe3Si
Силицид железа
3Fe + 2P = Fe3P2
Фосфид железа (II)
3Fe + C = Fe3C
Карбид железа (цементит)
3Fe + Si = Fe3Si
Силицид железа
3Fe + 2P = Fe3P2
Фосфид железа (II)
Слайд 9При высокой температуре раскаленное железо реагирует с водой:
3Fe + 4H2O =
Fe3O4 + 4H2
Железо реагирует с разбавленным серной и соляной кислотами, вытесняя из кислот водород:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
При обычной температуре железо не
взаимодействует с концентрированной серной кислотой, так как пассивируется ею.
Железо реагирует с разбавленным серной и соляной кислотами, вытесняя из кислот водород:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
При обычной температуре железо не
взаимодействует с концентрированной серной кислотой, так как пассивируется ею.
ХИМИЧЕСКИЕ СВОЙСТВА
Слайд 10ХИМИЧЕСКИЕ СВОЙСТВА
При нагревании концентрированная H2SO4 окисляет железо до сульфита железа (III):
2Fe
+ 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O.
Разбавленная азотная кислота окисляет железо до нитрата железа (III):
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
Концентрированная азотная кислота пассивирует железо.
Разбавленная азотная кислота окисляет железо до нитрата железа (III):
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
Концентрированная азотная кислота пассивирует железо.
Слайд 11ХИМИЧЕСКИЕ СВОЙСТВА
Из растворов солей железо вытесняет металлы, которые расположены
правее его в электрохимическом ряду напряжений:
Fe + CuSO4 = FeSO4 + Cu
Во влажном воздухе железо быстро окисляется (корродирует):
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Fe + CuSO4 = FeSO4 + Cu
Во влажном воздухе железо быстро окисляется (корродирует):
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Слайд 12СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙ)
Оксид железа (II) FeO – черное
кристаллическое вещество, нерастворимое в воде.
Оксид железа (II) – основной оксид, легко реагирует кислотами, при этом образуются соли железа(II):
FeO + 2HCl = FeCl2 + H2O
Оксид железа (II) – основной оксид, легко реагирует кислотами, при этом образуются соли железа(II):
FeO + 2HCl = FeCl2 + H2O
Слайд 13СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙ)
Гидроксид железа (II) Fe(OH)2 – порошок белого
цвета, не растворяется в воде. Получают его из солей железа (II) при взаимодействии их с щелочами:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
Гидроксид железа Fe(OH)2 проявляет свойства основания, легко реагирует с кислотами:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
При нагревании гидроксид железа (II) разлагается:
Fe(OH)2 = FeO + H2O.
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
Гидроксид железа Fe(OH)2 проявляет свойства основания, легко реагирует с кислотами:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
При нагревании гидроксид железа (II) разлагается:
Fe(OH)2 = FeO + H2O.
Слайд 14СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙ)
Так, свежеполученный осадок Fe(OH)2 на воздухе очень
быстро изменяет окраску – буреет. Изменение окраски объясняется окислением Fe(OH)2 в Fe(OH)3 кислородом воздуха:
4Fe(OH)2 + O2 + 2H2O = 4FeOH)3
Качественная реакция на катион железа (II).
Реактивом для определения катиона железа Fe2+ является гексациано (III) феррат калия (красная кровяная соль) K3[Fe(CN)6]:
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 +3K2SO4
Образуется темно-синий осадок – турнбулева синь.
4Fe(OH)2 + O2 + 2H2O = 4FeOH)3
Качественная реакция на катион железа (II).
Реактивом для определения катиона железа Fe2+ является гексациано (III) феррат калия (красная кровяная соль) K3[Fe(CN)6]:
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 +3K2SO4
Образуется темно-синий осадок – турнбулева синь.
Слайд 15СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙΙ)
Оксид железа (III) Fe2O3 – порошок бурого
цвета, не растворяется в воде.
Оксид железа (III) проявляет амфотерные свойства:
взаимодействует с твердыми щелочами NaOH и KOH при высокой температуре:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
феррит натрия
взаимодействует с кислотами:
Fe2O3 + 6НСl =2FeCl3 + 3H2O
Оксид железа (III) проявляет амфотерные свойства:
взаимодействует с твердыми щелочами NaOH и KOH при высокой температуре:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
феррит натрия
взаимодействует с кислотами:
Fe2O3 + 6НСl =2FeCl3 + 3H2O
Слайд 16СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙΙ)
Соединения со степенью окисления железа +3 проявляют
окислительные свойства, так как под действием восстановителей Fe+3 превращается в Fe+2.Так, например, хлорид железа (III) окисляет йодид калия до свободного йода:
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
Качественные реакции на катион железа (III):
а) реактивом для обнаружения катиона Fe3+ является гексациано (II) феррат калия (желтая кровяная соль) K4[Fe(CN)6].
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
Качественные реакции на катион железа (III):
а) реактивом для обнаружения катиона Fe3+ является гексациано (II) феррат калия (желтая кровяная соль) K4[Fe(CN)6].
Слайд 17СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙΙ)
Образуется темно-синий осадок – берлинская лазурь
4FeCl3 + 3K4[Fe(CN)6]
Fe4[Fe(CN)6]3 +12KCl
б) катионы Fe3+ легко обнаруживаются с помощью роданида аммония (NH4CNS). В результате образуется малодиссоциирующий роданид железа (III) кроваво-красного цвета:
FeCl3 + 3NH4CNS Fe(CNS)3 + 3NH4Cl
б) катионы Fe3+ легко обнаруживаются с помощью роданида аммония (NH4CNS). В результате образуется малодиссоциирующий роданид железа (III) кроваво-красного цвета:
FeCl3 + 3NH4CNS Fe(CNS)3 + 3NH4Cl
Слайд 18ЖЕЛЕЗО И ПИЩА
Железо поступает в организм с пищей. Суточная потребность взрослого
человека в железе составляет 11-30мг.
Пищевое железо существует в двух формах: гемм – восстановительный гематин – железо, находящееся в красном мясе, цыплятах, морепродуктах и других продуктах животного происхождения, и нонгемм – железо, которое можно обнаружить в темно-зеленых овощах, цельных злаках, орехах, сухофруктах и в других растительных продуктах.
Пищевое железо существует в двух формах: гемм – восстановительный гематин – железо, находящееся в красном мясе, цыплятах, морепродуктах и других продуктах животного происхождения, и нонгемм – железо, которое можно обнаружить в темно-зеленых овощах, цельных злаках, орехах, сухофруктах и в других растительных продуктах.
Слайд 19ЖЕЛЕЗО И ПИЩА
Многие мучные продукты витаминизированы железом. Гемм железо легче усваивается
организмом, однако потребление продуктов, содержащих нонгемм железо, наряду с продуктами, содержащими гемм железо или витамин С, максимизируется усвоением железа.
Кофе, чай, продукты из сои препятствуют усвоению железа, как это делают излишние количества кальция, цинка и марганца.
Кофе, чай, продукты из сои препятствуют усвоению железа, как это делают излишние количества кальция, цинка и марганца.
Слайд 20Содержание железа в продуктах питания (на 100 г )
Халва тахинная 26
Печень говяжья 6,90
Крупа гречневая 6,65
Хлеб пшеничный 3,95
Говядина 2,90
Яйцо куриное 2,50
Яблоки 2,20
Скумбрия 1,70
Смородина черная 1,30
Сыры твердые 1,20
Картофель 0,90
Капуста белокочанная 0,62
Творог 0,46
Печень говяжья 6,90
Крупа гречневая 6,65
Хлеб пшеничный 3,95
Говядина 2,90
Яйцо куриное 2,50
Яблоки 2,20
Скумбрия 1,70
Смородина черная 1,30
Сыры твердые 1,20
Картофель 0,90
Капуста белокочанная 0,62
Творог 0,46
Слайд 21СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Габриелян, О.С. Химия. 9 класс: учебник [Текст] /
О.С.Габриелян. – 2-е изд., стереотип. – М.: Дрофа, 2014. – 319,[1]с: и.
ISBN 978-5-358-13386-0
Все о химии.[Электронный ресурс]. – Режим доступа: http://himya.ucoz.ru/index/zhelezo/0-144, свободный. Загл. с экрана
Яндекс. Картинки.
ISBN 978-5-358-13386-0
Все о химии.[Электронный ресурс]. – Режим доступа: http://himya.ucoz.ru/index/zhelezo/0-144, свободный. Загл. с экрана
Яндекс. Картинки.















![Презентация по химии на тему Железо СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙΙ)Образуется темно-синий осадок – берлинская лазурь4FeCl3 + 3K4[Fe(CN)6] СОЕДИНЕНИЯ ЖЕЛЕЗА (ΙΙΙ)Образуется темно-синий осадок – берлинская лазурь4FeCl3 + 3K4[Fe(CN)6] Fe4[Fe(CN)6]3 +12KClб) катионы Fe3+ легко обнаруживаются](/img/thumbs/2f83f8eaa623ec93b3ce5eefcb6738a1-800x.jpg)



![Презентация по химии на тему Железо СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ1. Габриелян, О.С. Химия. 9 класс: учебник [Текст] / СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ1. Габриелян, О.С. Химия. 9 класс: учебник [Текст] / О.С.Габриелян. – 2-е изд., стереотип. –](/img/thumbs/3474dcb07eced1a524bdc24fab1b0cd1-800x.jpg)





