- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Железо и его соединения (9 класс)
Содержание
- 1. Презентация по химии на тему: Железо и его соединения (9 класс)
- 2. Цели урокаНа основе уже имеющихся общих знаний
- 3. Содержание: 1.Расположение в ПСХЭ2.Строение атома3. Нахождение в
- 4. Расположение в ПСХЭFeЛатинское название
- 5. Строение атома железа
- 6. Нахождение в природеFeМного железа содержится и в
- 7. Получение железаЖелезо получают в виде сплава восстановлением из его соединений при высоких температурах в доменных печах.
- 8. Физические свойства железаТяжелый (плотность=7,8 г\см3 )Ковкий;Обладает магнитными свойствамиСеребристо-серый Тугоплавкий (Т пл.=15350C)
- 9. Химические свойства железаВзаимодействие железа с хлором2Fe + 3Cl2 = 2FeCl3https://www.youtube.com/watch?v=w6wc4PG0-es
- 10. Химические свойства железаВзаимодействие железа с кислородом 4Fe +3O2=2Fe2O3https://www.youtube.com/watch?v=o9Rvc3Vae_c
- 11. Химические свойства железаВзаимодействия железа с серой
- 12. Химические свойства железаРеакции со сложными веществами С
- 13. Химические свойства железаЖелезо разрушается под действием окружающей
- 14. Соединения железаоксиды:FeO,
- 15. Соединения железаОксиды железаFeO –основный оксидFe3O4-смешанный оксид (FeO и Fe2O3)Fe2O3- слабовыраженный амфотерный оксид
- 16. Соединения железаХимические свойства FeO1) с кислотами:FeO +
- 17. Соединения железаХимические свойства Fe3O41) с кислотамиFe3O4 +
- 18. Соединения железаГидроксиды железаFe(OH)2 Fe(OH)3
- 19. Соединения железаFe(OH)2 и Fe(OH)3 1)Реагируют
- 20. Качественные реакции на ионы Fe²⁺ и Fe³⁺FeCl2
- 21. Качественные реакции на ионы Fe²⁺ На
- 22. Качественные реакции на ионы Fe³⁺ FeCl3 +
- 23. ПрименениеЖелезо - самый употребляемый металл, на него
- 24. Используемая литература: Учебник для 9
Слайд 1Железо и его соединения
урок в 9 классе
Автор разработки:
Учитель химии и биологии
ГУ
Цюпай Екатерина Сергеевна
Слайд 2Цели урока
На основе уже имеющихся общих знаний о металлах дать представление
Рассмотреть важнейшие соединения железа (II) и (III), качественные реакции на ионы железа.
Слайд 3Содержание:
1.Расположение в ПСХЭ
2.Строение атома
3. Нахождение в природе
4.Получение железа
5.Физические свойства
6.Химические свойства
7.Соединения железа
8.Качественные
9.Применение
10. Литература
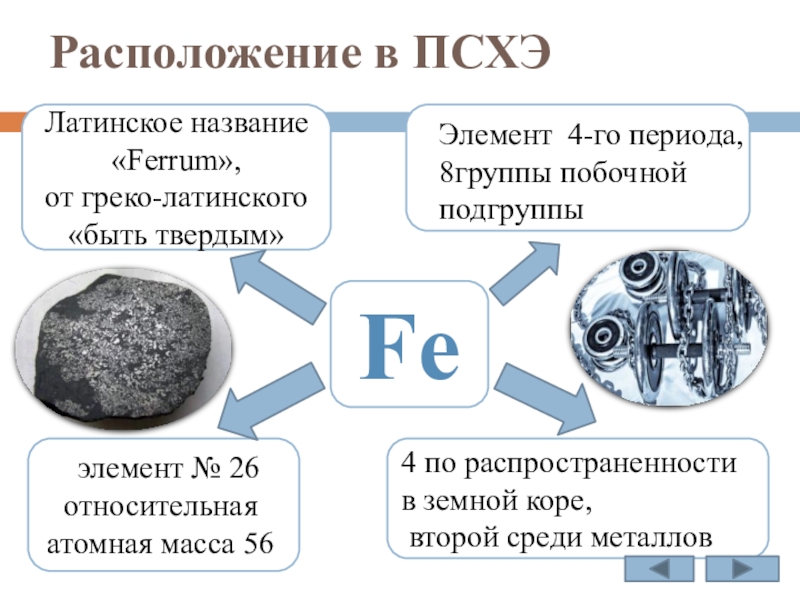
Слайд 4Расположение в ПСХЭ
Fe
Латинское название
от греко-латинского
«быть твердым»
4 по распространенности в земной коре,
второй среди металлов
элемент № 26 относительная атомная масса 56
Элемент 4-го периода,
8группы побочной
подгруппы
Слайд 5Строение атома железа
2e 8e 14e 2e
1S22S22P63S23P63D64S2
возможные степени окисления+2 и +3
+ 26
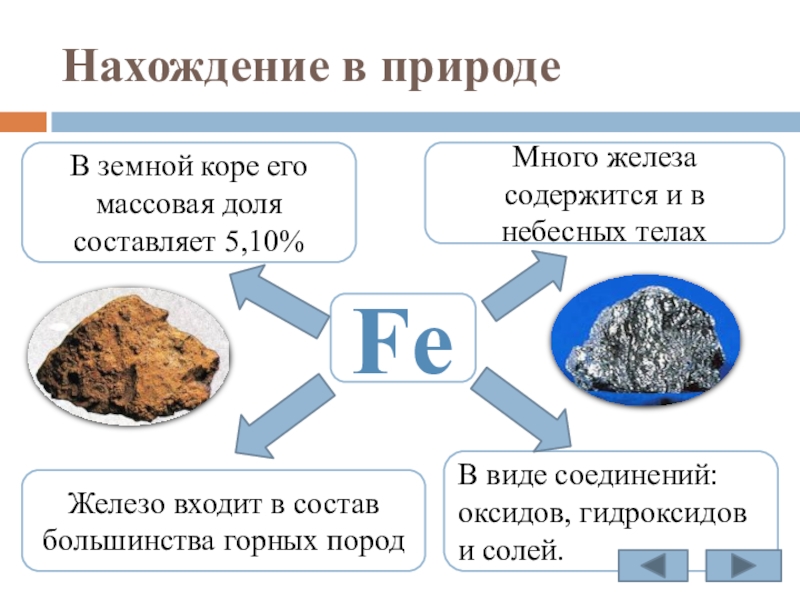
Слайд 6Нахождение в природе
Fe
Много железа содержится и в небесных телах
В земной коре
В виде соединений: оксидов, гидроксидов и солей.
Железо входит в состав большинства горных пород
Слайд 7Получение железа
Железо получают в виде
сплава восстановлением
из его соединений при
высоких температурах в
доменных печах.
Слайд 8Физические свойства железа
Тяжелый (плотность=7,8 г\см3 )
Ковкий;
Обладает магнитными свойствами
Серебристо-серый
Тугоплавкий
(Т пл.=15350C)
Слайд 9Химические свойства железа
Взаимодействие железа с хлором
2Fe + 3Cl2 = 2FeCl3
https://www.youtube.com/watch?v=w6wc4PG0-es
Слайд 10Химические свойства железа
Взаимодействие железа с кислородом
https://www.youtube.com/watch?v=o9Rvc3Vae_c
Слайд 11Химические свойства железа
Взаимодействия железа с серой
https://www.youtube.com/watch?v=jzEnZ6B7xNA
Слайд 12Химические свойства железа
Реакции со сложными веществами
С кислотами:
А) с соляной кислотой
2HCL
Б) с серной кислотой
H2SO4 + Fe = FeSO4 + H2
С солями:
Fe + CuSO4= Cu + FeSO4
С водой(при высокой температуре):
3Fe + 4H2O=Fe3O4 +4H2
(железная окалина)
Слайд 13Химические свойства железа
Железо разрушается под действием окружающей среды, т.е. подвергается коррозии
При этом на поверхности образуется «ржавчина». 4Fe + 2Н2О + ЗО2 = 2(Fe2O3•Н2О)
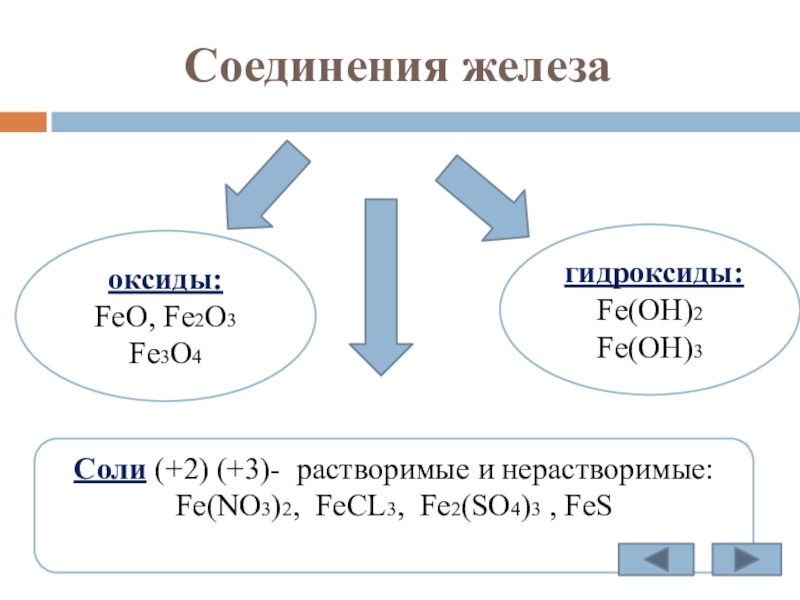
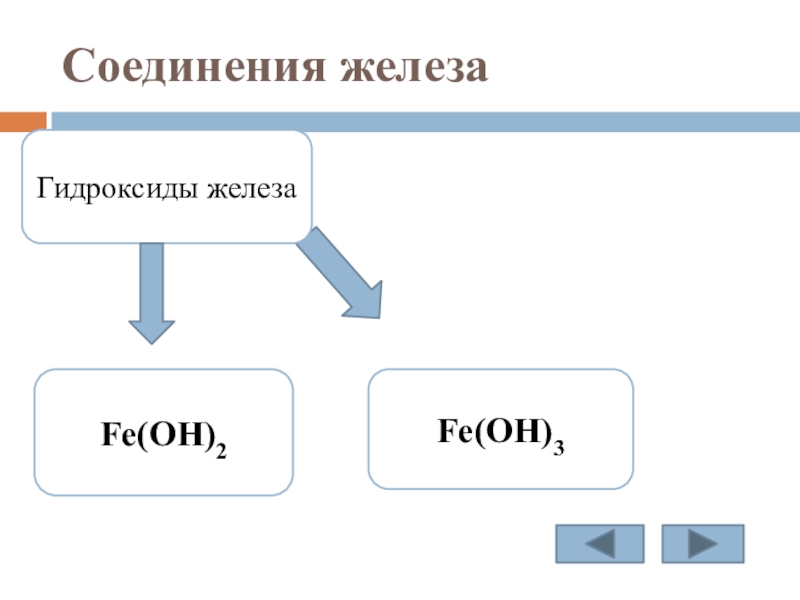
Слайд 14 Соединения железа
оксиды:
FeO, Fe2O3
Fe3O4
гидроксиды:
Fe(OH)2
Fe(OH)3
Соли (+2)
Fe(NO3)2, FeCL3, Fe2(SO4)3 , FeS
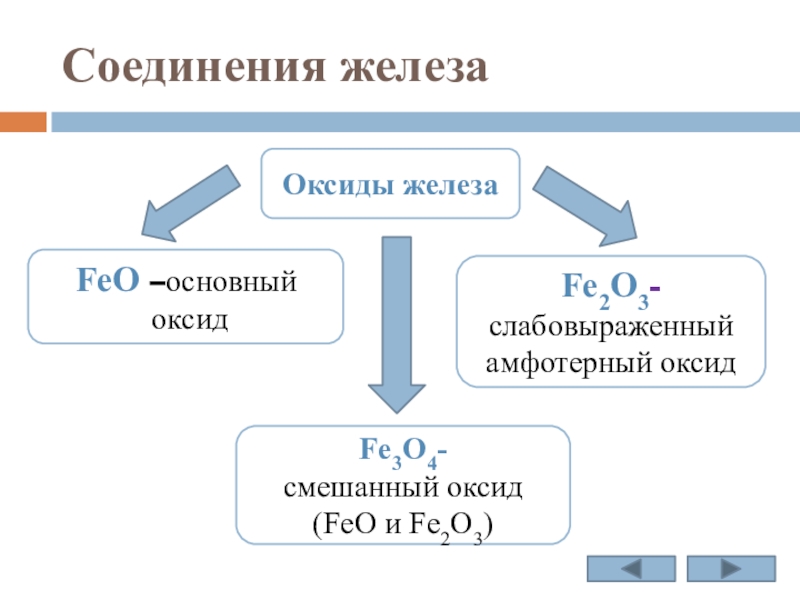
Слайд 15Соединения железа
Оксиды железа
FeO –основный
оксид
Fe3O4-
смешанный оксид (FeO и Fe2O3)
Fe2O3- слабовыраженный амфотерный
Слайд 16Соединения железа
Химические свойства FeO
1) с кислотами:
FeO + 2HCL=FeCL2 + H2O
2) с
3FeO + 2Al = 3Fe + Al2O3
Химические свойства Fe2O3
1) с кислотами:
Fe2O3 + 3H2SO4=Fe2(SO4)3 + 3H2O
2) с более активными металлами
Fe2O3 + 3Mg=3MgO +2Fe
Слайд 17Соединения железа
Химические свойства Fe3O4
1) с кислотами
Fe3O4 + 8HCL=FeCL2 +2FeCL3 + 4H2O
2)
Fe3O4 +4 Zn=4 ZnO +3Fe
Слайд 19Соединения железа
Fe(OH)2 и Fe(OH)3
1)Реагируют с кислотами:
Fe(OH)2 + 2HNO3=
Fe(OH)3 + 3HCL=FeCl3+3H2O
2)Разлагаются при нагревании:
2Fe(OH)3 = Fe2O3+3H2O
Fe(OH)2=FeO + H2O
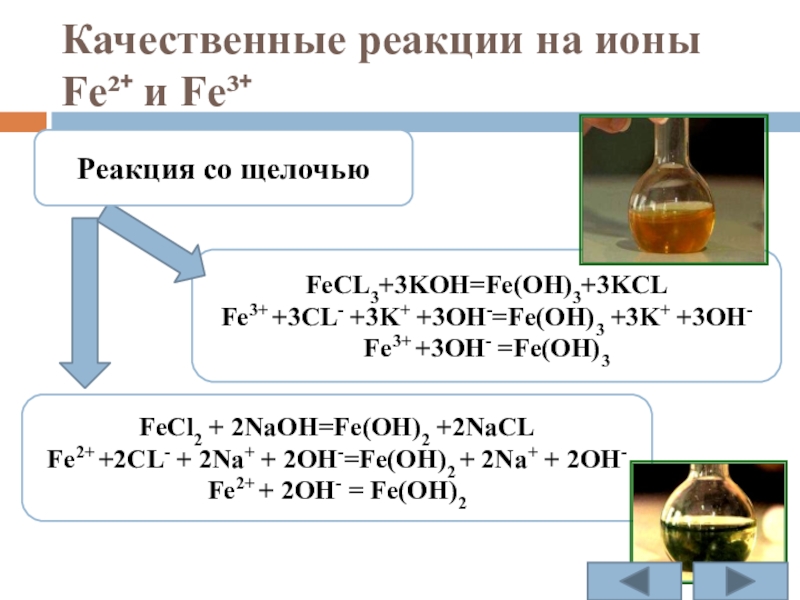
Слайд 20Качественные реакции на ионы Fe²⁺ и Fe³⁺
FeCl2 + 2NaOH=Fe(OH)2 +2NaCL
Fe2+ +2CL-
Fe2+ + 2OH- = Fe(OH)2
FeCL3+3KOH=Fe(OH)3+3KCL
Fe3+ +3CL- +3K+ +3OH-=Fe(OH)3 +3K+ +3OH-
Fe3+ +3OH- =Fe(OH)3
Реакция со щелочью
Слайд 21Качественные реакции на ионы Fe²⁺
На ион Fe2+ - взаимодействие с
Fe+2SO4+K3[Fe(CN)6]=KFe+3[Fe+2(CN)6]↓+K2SO4
синего цвета «турнбулева синь»
https://www.youtube.com/watch?v=gcVOcXvnr7s
Слайд 22Качественные реакции на ионы Fe³⁺
FeCl3 + 3KSCN Fe(SCN)3 +3KCl
Fe+3CI3+3NH4SCN Fe(SCN)3↓+3NH4C
роданид аммония кроваво-красного цвета
https://www.youtube.com/watch?v=eIVusMfUa6Y
Слайд 23Применение
Железо - самый употребляемый металл, на него приходится до 90 %
Применяют для изготовления трансформаторов, электромоторов и мембран микрофонов. Основная масса железа на практике используется в виде сплавов – чугуна и стали.
Слайд 24
Используемая литература:
Учебник для 9 кл.общеобразоват.шк./Н.Н.Нурахметов,К.М.Джексембина,Н.А.
Заграничная и др.-3-е изд.,перераб.,доп.- Алматы: Мектеп,2013.
Интернет
www.catalogmineralov.ru – сайт содержит каталог минералов,
http://.elementy.ru – сайт « Элементы большой науки», содержит каталоги и статьи научно-популярных журналов «Химия и жизнь», « Наука и жизнь», «Природа» и др.
http://alhimik.ru – сайт «Алхимик» содержит самую разнообразную информацию по химии.
Видео фрагменты:
Реакция железа с серой: https://www.youtube.com/watch?v=jzEnZ6B7xNA
железа с хлором: https://www.youtube.com/watch?v=w6wc4PG0-es
железа с кислородом: https://www.youtube.com/watch?v=o9Rvc3Vae_c
Качественные реакции: https://www.youtube.com/watch?v=eIVusMfUa6Y
https://www.youtube.com/watch?v=gcVOcXvnr7s