- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Железо
Содержание
- 1. Презентация по химии на тему Железо
- 2. Человек не может обойтись без металлов… Если
- 3. «На улицах стоял бы ужас разрушения:
- 4. Тема урокаМеталлы побочных подгрупп: железо
- 5. Определить степень окисления железа в соединениях:FeO,Fe2O3, FeSO4, Fe2(SO4)3, K2FeO4.
- 6. Одинаковую степень окисления железо проявляет в соединениях:1.FeO
- 7. Работа с текстом“+” - поставьте на полях,
- 8. Проанализировав Таблицу 1 «Металлы в организме человека» ответьте: Где
- 9. Качественные реакции на ионы железа 2+ и
- 10. Записать уравнения реакций к схеме:
- 11. Взаимопроверка1) Fe + 2HCl = FeCl2
- 12. 2. Выполнить тест: учебник стр.149
- 13. Задание на дом:§32 стр.146 – 147 Задачи №3,4 стр.149
- 14. Проверка домашнего заданияУпражнение №5 Al2 (SO4)3+ KOH(нед)
- 15. ОтветыУпражнения №51.Al2 (SO4)3 + 6KOH(нед.) = 2AL(OH)3
- 16. Упражнение №62Al +3Cl2 = 2AlCl3AlCl3 + 3NaOH
- 17. Изучение нового материалаХарактеристика по плану:1.Положение железа в
- 18. Характеристика элемента4-период, 4ряд, 8-группа, побочная подгруппа, порядковый
- 19. Физические свойства железаСеребристо-серый, мягкий металл, обладает хорошей
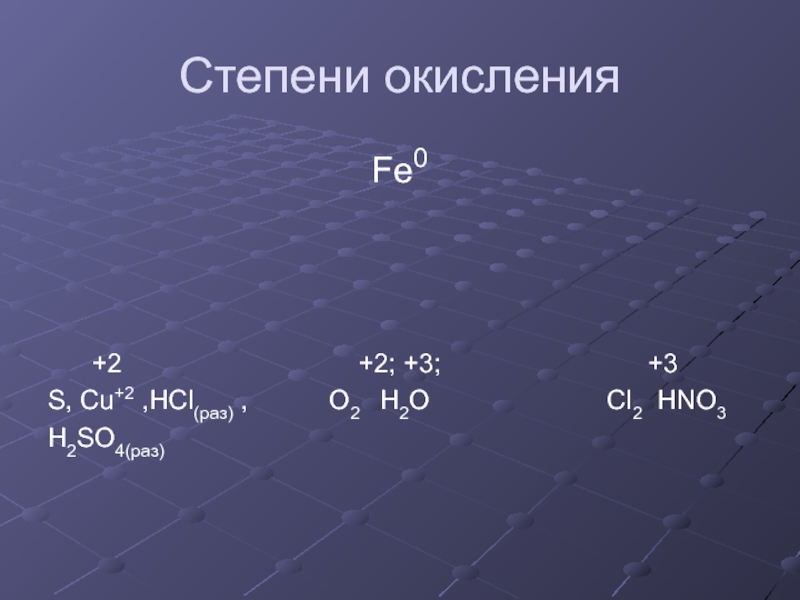
- 20. Степени окисленияFe0 +2
- 21. Химические свойстваПри нагревании2Fe + 3Cl2 =2FeCl33Fe +2O2=
- 22. Химические свойства Fe + CuSO4 = Cu
- 23. При нагревании2Fe + 6H2SO4(k)=Fe2(SO4)3 + 3SO2+6H2OFe+ 6HNO3(k)= Fe(NO3)3+ 3NO2+ 3H2O
- 24. Химические свойства Fe0
- 25. Уравнивание реакций5Fe0 + 12 HN+5 O3 (p)
- 26. Минералы железоFe3O4 магнитный железняк или магнетит Fe2O3
- 27. ПрименениеМагнитный, красный, бурый железняки –для производства черной
- 28. Источники железаШпинатСалатКапустаЧерная черешняГовядинаТелятина
- 29. §32 стр.146 – 147 Задачи №3,4 стр.149Дом.задание
Человек не может обойтись без металлов… Если бы не металлы, человек влачил бы самую омерзительную и жалкую жизнь среди диких зверей Георг Агрикола
Слайд 1Выберите элементы побочных подгрупп
1) 2, 8, 2
2) 2, 8, 12, 2
3) 2, 8, 9, 2
4) 2, 8, 8, 1
5) 2,8,14,2
Слайд 2Человек не может обойтись без металлов… Если бы не металлы, человек влачил
бы самую омерзительную и жалкую жизнь
среди диких зверей
Георг Агрикола
ХIХ в.
Немецкий учёный, считающийся одним из отцов минералогии.
Слайд 3 «На улицах стоял бы ужас разрушения: ни рельсов, ни вагонов,
ни паровозов, ни автомобилей не оказалось бы, даже камни мостовой превратились бы в глинистую труху, а растения начали бы чахнуть и гибнуть без этого металла. Разрушение ураганом прошло бы по всей Земле, и гибель человечества сделалась бы неминуемой. Впрочем, человек не дожил бы до этого момента, ибо лишившись трех граммов этого металла в своем теле и в крови, он бы прекратил свое существование раньше, чем развернулись бы нарисованные события».
Академик
геохимик
А.Е.Ферсман
1883-1945
Слайд 6Одинаковую степень окисления железо проявляет в соединениях:
1.FeO и FePO4
2. FeO
и FeCO3
3. Fe(OH)3 и FeCl2
4. Fe2O3 и Fe(NO3)2
5. Fe2O3 и FePO4
3. Fe(OH)3 и FeCl2
4. Fe2O3 и Fe(NO3)2
5. Fe2O3 и FePO4
Слайд 7Работа с текстом
“+” - поставьте на полях, если то, что вы
читаете, соответствует тому что вы знаете;
“-” - поставьте на полях, если то, что вы читаете, противоречит тому что вы знали или думали что это знаете;
“V” - поставьте на полях, если то, что вы читаете, является новым;
“?” - поставьте на полях, если то, что вы читаете, является непонятным или вы хотели бы получить более подробные сведения по данному вопросу.
“-” - поставьте на полях, если то, что вы читаете, противоречит тому что вы знали или думали что это знаете;
“V” - поставьте на полях, если то, что вы читаете, является новым;
“?” - поставьте на полях, если то, что вы читаете, является непонятным или вы хотели бы получить более подробные сведения по данному вопросу.
Слайд 8Проанализировав Таблицу 1 «Металлы в организме человека» ответьте: Где содержится в основном железо
в организме?
Что нужно делать при недостатке железа в организме? Какие продукты употреблять?
По Таблице 2 «Содержание железа в продуктах питания» определите, в каких продуктах больше всего содержится железа?
Что нужно делать при недостатке железа в организме? Какие продукты употреблять?
По Таблице 2 «Содержание железа в продуктах питания» определите, в каких продуктах больше всего содержится железа?
Слайд 9Качественные реакции на ионы железа 2+ и 3+
ПРОБЛЕМА ЧТО ЕСТЬ
ДЛЯ РЕШЕНИЯ ЧЕГО НЕ ХВАТАЕТ РЕШЕНИЕ
Слайд 10Записать уравнения реакций к схеме:
FeSO4
10
1 2 3 4 5
Fe → FeCl2→ Fe(OH)2 → FeO → Fe →
6 7 8 9
FeCl3→ Fe(OH)3 → Fe2O3 → Fe → Fe(NO3)3
10
1 2 3 4 5
Fe → FeCl2→ Fe(OH)2 → FeO → Fe →
6 7 8 9
FeCl3→ Fe(OH)3 → Fe2O3 → Fe → Fe(NO3)3
Слайд 11Взаимопроверка
1) Fe + 2HCl = FeCl2 + H2
2) FeCl2 +
2NaОН = Fe(OH)2↓ + 2NaCl
3) Fe(OH)2 = FeO + H2O
4) FeO + H2 = Fe + H2O
5) 2Fe + 3Cl2 = 2FeCl3
6) FeCl3 + 3NaОН = Fe(OH)3↓ + 3NaCl
7) 2Fe(OH)3 = Fe2O3 + 3H2O
8) Fe2O3 + 3СO = 2Fe + 3СO2 или
Fe2O3 + 3H2 = 2Fe + 3H2O
9) Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Разб.
или Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O.
Конц.
10) Fe(OH)2 + H2SO4 = FeSO4 + H2O
3) Fe(OH)2 = FeO + H2O
4) FeO + H2 = Fe + H2O
5) 2Fe + 3Cl2 = 2FeCl3
6) FeCl3 + 3NaОН = Fe(OH)3↓ + 3NaCl
7) 2Fe(OH)3 = Fe2O3 + 3H2O
8) Fe2O3 + 3СO = 2Fe + 3СO2 или
Fe2O3 + 3H2 = 2Fe + 3H2O
9) Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Разб.
или Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O.
Конц.
10) Fe(OH)2 + H2SO4 = FeSO4 + H2O
Слайд 14Проверка домашнего задания
Упражнение №5
Al2 (SO4)3+ KOH(нед) =
Al 2(SO4)3+ KOH(изб.)
=
Упражнение №6
Al ? AlCl3 ? Al(OH)3 ? Al2 O3 ? NaAlO2 ? Al 2(SO4)3 ? Al(OH)3 ? AlCl3 ? NaAlO2
Упражнение №6
Al ? AlCl3 ? Al(OH)3 ? Al2 O3 ? NaAlO2 ? Al 2(SO4)3 ? Al(OH)3 ? AlCl3 ? NaAlO2
Слайд 15Ответы
Упражнения №5
1.Al2 (SO4)3 + 6KOH(нед.) = 2AL(OH)3 +3K2SO4
2. Al2 (SO4)3 +
8KOH(изб) = 2KAlO2 + 3K2SO4 +
4H2O
4H2O
Слайд 16Упражнение №6
2Al +3Cl2 = 2AlCl3
AlCl3 + 3NaOH =Al(OH)3 + 3NaCl
2Al(OH)3 =
Al2O3 + 3H2O
Al2O3 +2NaOH =2NaAlO2 + H2O
2NaAlO2 + 4H2SO4(изб.) = Na2SO4 + Al2 (SO4 )3 +4H2O
Al2 (SO4 ) + 6NaOH = 2Al (OH)3 + 3Na2 SO4
Al(OH)3 +3HCl =AlCl3 + 3H2O
AlCl3 + 4NaOH(избыт.)= NaAlO2 + 3NaCl + 2H2O
Al2O3 +2NaOH =2NaAlO2 + H2O
2NaAlO2 + 4H2SO4(изб.) = Na2SO4 + Al2 (SO4 )3 +4H2O
Al2 (SO4 ) + 6NaOH = 2Al (OH)3 + 3Na2 SO4
Al(OH)3 +3HCl =AlCl3 + 3H2O
AlCl3 + 4NaOH(избыт.)= NaAlO2 + 3NaCl + 2H2O
Слайд 17Изучение нового материала
Характеристика по плану:
1.Положение железа в ПСХЭ (период, ряд, группа,
подгруппа, порядковый номер)
2.Атомное строение(число электронов, протонов , нейтронов, относительная атомная масса)
3.Электронные слои, распределение электронов по слоям, электронная конфигурация.
2.Атомное строение(число электронов, протонов , нейтронов, относительная атомная масса)
3.Электронные слои, распределение электронов по слоям, электронная конфигурация.
Слайд 18Характеристика элемента
4-период, 4ряд, 8-группа, побочная подгруппа, порядковый номер 26
26 электронов, 26
протонов, относительная атомная масса 56, 30 нейтронов.
4 электронных слоя, 2)8)14)2), электронная конфигурация 1s22s2p63s2p6d64s2
Степень окисления 0,+2, +3 ,+4 и иногда + 6; является восстановителем
4 электронных слоя, 2)8)14)2), электронная конфигурация 1s22s2p63s2p6d64s2
Степень окисления 0,+2, +3 ,+4 и иногда + 6; является восстановителем
Слайд 19Физические свойства железа
Серебристо-серый, мягкий металл, обладает хорошей пластичностью, ковкостью и способностью
к намагничиванию.
Плотность 7,864г/см3, температура плавления 1539 * С
Плотность 7,864г/см3, температура плавления 1539 * С
Слайд 21Химические свойства
При нагревании
2Fe + 3Cl2 =2FeCl3
3Fe +2O2= Fe3O4 (FeO Fe2O3)
Fe +S
=FeS
При очень высокой температуре
4Fe + 3C =Fe4C3
4Fe + 3Si =Fe4Si3
3Fe + 2P = Fe3P2
При очень высокой температуре
4Fe + 3C =Fe4C3
4Fe + 3Si =Fe4Si3
3Fe + 2P = Fe3P2
Слайд 22Химические свойства
Fe + CuSO4 = Cu + FeSO4
Fe + 2HClр
= FeCl2 + H2
Fe + H2SO4 p= FeSO4 + H2
Fe + H2SO4(k) =/=
Fe + HNO3 (к)=/=
Fe + H2SO4 p= FeSO4 + H2
Fe + H2SO4(k) =/=
Fe + HNO3 (к)=/=
Слайд 24 Химические свойства Fe0 + HNO3 (p) Fe +2(NO3 )2 +
N20 + H2 O
Fe0 + HNO3(р) Fe+3 (NO3)3 + N+2 O + H20
Fe0 + HNO3(р) Fe+2(NO3)2 + N-3 H4 N+5 O3+ H2O
Слайд 25Уравнивание реакций
5Fe0 + 12 HN+5 O3 (p) = 5Fe +3(NO3 )2
+ N20 +6 H2 O
вос-ль окис-ль
Fe0 - 2e = Fe+2 10 1 2N+5 + 10e = N20 2 5
Fe0 +4 HN+5 O3 = Fe+3 (NO3)3 + N+2 O + 2H20 Fe0 - 3e = Fe+3 3 1 N+5 + 3e = N+2 3 1
Fe0 – восстановитель
HNO3 – окислитель
4Fe0 +10 HNO3 =4 Fe+2(NO3)2 + N-3 H4 N+5 O3+ 3H2O
вос-ль окис-ль
Fe0 - 2e = Fe+2 8 4 N+5 + 8e = N-3 2 1
вос-ль окис-ль
Fe0 - 2e = Fe+2 10 1 2N+5 + 10e = N20 2 5
Fe0 +4 HN+5 O3 = Fe+3 (NO3)3 + N+2 O + 2H20 Fe0 - 3e = Fe+3 3 1 N+5 + 3e = N+2 3 1
Fe0 – восстановитель
HNO3 – окислитель
4Fe0 +10 HNO3 =4 Fe+2(NO3)2 + N-3 H4 N+5 O3+ 3H2O
вос-ль окис-ль
Fe0 - 2e = Fe+2 8 4 N+5 + 8e = N-3 2 1
Слайд 26Минералы железо
Fe3O4 магнитный железняк или магнетит
Fe2O3 красный железняк или
гематит
2Fe2O3.3H2O бурый железняк или лимонит
FeS2 железный или серный колчедан
FeSO4.7H2O железный купорос
2Fe2O3.3H2O бурый железняк или лимонит
FeS2 железный или серный колчедан
FeSO4.7H2O железный купорос
Слайд 27Применение
Магнитный, красный, бурый железняки –для производства черной металлургии (чугуна и стали)
Железный
колчедан – для производства серной кислоты
Железный купорос– для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины
Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Чугун и сталь в технике и в быту.
Хлорид железа(lll)– при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа(lll) при очистке воды, в качестве растворителя в гидрометаллургии .
Железный купорос– для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины
Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Чугун и сталь в технике и в быту.
Хлорид железа(lll)– при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа(lll) при очистке воды, в качестве растворителя в гидрометаллургии .