- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Железо (9 класс)
Содержание
- 1. Презентация по химии на тему Железо (9 класс)
- 2. Цель: Познакомить с химическим элементом
- 3. Тип урока: изучение нового учебного материала.Методы: словесный, наглядный, практическийФормы работы: индивидуальные, коллективные
- 4. Эпиграф к урокуЧеловек не может обойтись без
- 5. Отрывок из «Поэмы о периодическом законе», В.
- 6. Сообщение ученика. 30 июня 1908 году эвенка
- 7. Тема урока:«Железо. Положение в ПСХЭ. Строение атома.
- 8. Что можно дополнительно сказать
- 9. Что можно дополнительно сказать о железе на
- 10. Что можно дополнительно сказать о железе на
- 11. Что можно дополнительно сказать о железе на
- 12. Что можно дополнительно сказать о железе на
- 13. Что можно дополнительно сказать о железе на
- 14. Что можно дополнительно сказать о железе на
- 15. Что можно дополнительно сказать о железе на
- 16. Нахождение в природеБыло время, когда железо ценилось
- 17. Получение Железо получают в виде сплава восстановлением из его соединений при высоких температурах в доменных печах.
- 18. ПолучениеЖелезо получают в виде сплава восстановлением из
- 19. ПолучениеЖелезо получают в виде сплава восстановлением из
- 20. ПолучениеЖелезо получают в виде сплава восстановлением из
- 21. Физические свойстваFe – металл серебристо – белого
- 22. Физические свойстваFe – металл серебристо – белого
- 23. Химические свойства
- 24. Химические свойстваОкисляется активными неметаллами: Fe + S = FeS 2Fe + 3Cl2 = 2FeCl3
- 25. Химические свойстваОкисляется активными неметаллами: Fe + S =
- 26. Химические свойстваОкисляется активными неметаллами: Fe + S =
- 27. Химические свойстваОкисляется активными неметаллами: Fe + S =
- 28. Химические свойстваВзаимодействует с кислотами (кроме HNO3(конц) и
- 29. Химические свойстваВзаимодействует с кислотами (кроме HNO3(конц) и
- 30. Соединения железа. I. FeO – порошок черного
- 31. Биологическая роль железаБиохимики открыли важную роль железа
- 32. Биологическая роль железаЖелезо необходимо и растениям. Оно
- 33. Применение.Чистое железо применяется для изготовления деталей электромагнитного
- 34. Самостоятельная работаОпределите степени окисления железа в соединениях: FеСl3, FеSО4, Fе(ОН)2, Fе(ОН)3, Fе2(SО4)3, FеВr2
- 35. Самостоятельная работаОпределите степени окисления железа в соединениях: FеСl3,
- 36. Работа в рабочей тетради Упр. 236, 238, 239, стр. 68-70
- 37. Тест По распространенности в земной коре железо
- 38. Ответы1 – а2 – с3 – с4 – а5 – в6 – в
- 39. Домашнее задание§35, стр. 118-120, упр. 8-9, стр.
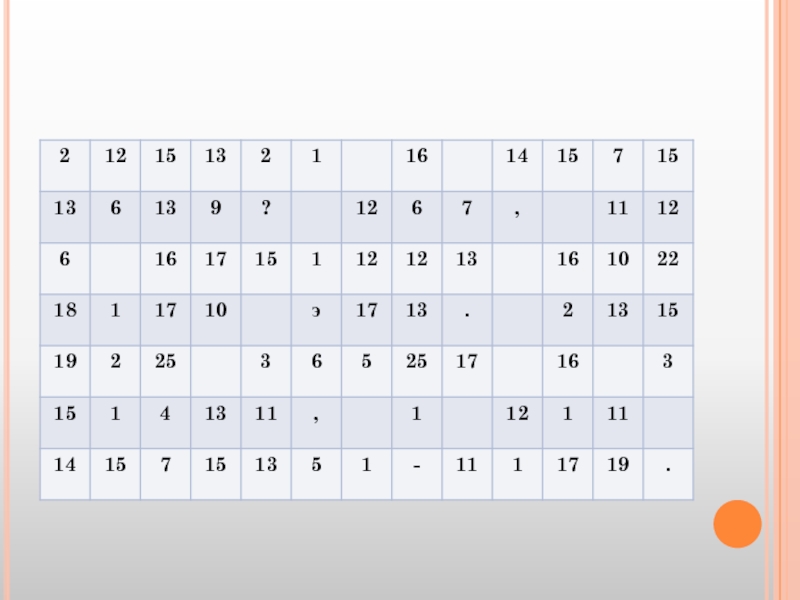
- 40. Задание:Разгадав ключевые слова и заменив цифры буквами
- 41. Слайд 41
- 42. Вопросы к заданиюБог войны, атрибуты которого использовали
- 43. Пир Соломона (легенда) Рассказывают, что после
- 44. Но царь Соломон недаром был прозван мудрым.
- 45. Железо не только основа всего мира, самый
- 46. Всем большое спасибо за урок.
- 47. Предметная неделя февраль 2011 годУчитель химии Якуша Татьяна Александровна
Слайд 1Открытый урок
по химии в 9 классе
«Железо. Положение в ПСХЭ. Строение атома.
Слайд 2
Цель: Познакомить с химическим элементом железом и его характеристикой.
Задачи:
1. Рассмотреть
2. Развивать интеллектуальные умения: выделять главное, анализировать, сравнивать, делать выводы, использовать ранее накопленные знания по химии в контексте нового материала, расширить научную лексику путем введения в активный словарь новых терминов;
3. Воспитывать коммуникативные навыки, формировать научное мировоззрение, интерес к предмету, поддерживать устойчивую мотивацию к изучению химии на основании положительного эмоционального восприятия предмета.
Слайд 3Тип урока: изучение нового учебного материала.
Методы: словесный, наглядный, практический
Формы работы: индивидуальные,
Слайд 4Эпиграф к уроку
Человек не может обойтись без металлов…
Если бы не было
влачили бы самую омерзительную и
жалкую жизнь среди диких зверей…
Георг Агрокола, 1556 г
Слайд 5Отрывок из «Поэмы о периодическом законе», В. Половняк:
Громоподобные раскаты
И в небе
Слайд 6Сообщение ученика.
30 июня 1908 году эвенка Чучанги рассказывал: «Тут я
При падении Тунгусского метеорита по всей Центральной Сибири был виден ослепительно-яркий свет. Установлено, что в земную атмосферу со скоростью 70 км/с влетело метеоритное тело массой 1000000 т. Удары огромной силы, подобные взрывам, были слышны, в тысяче километров от места падения! Куски «небесного тела», которые называют «метеоритами», бывают похожи на камни черно-бурого цвета. В свободном состоянии железо встречается только в метеоритах. Ежесуточно на Землю выпадают до 10 т метеоритного вещества.
Слайд 7Тема урока:
«Железо. Положение в ПСХЭ. Строение атома. Физические и химические свойства
Слайд 8 Что можно дополнительно сказать о железе на основании положения его в
Слайд 9Что можно дополнительно сказать о железе на основании положения его в
Fe – VIIIБ группа, 3 период, 3 ряд
Слайд 10Что можно дополнительно сказать о железе на основании положения его в
Fe – VIIIБ группа, 3 период, 3 ряд
№26 Ar(Fe) = 56 (26p, 30n)26ℯ
Слайд 11Что можно дополнительно сказать о железе на основании положения его в
Fe – VIIIБ группа, 3 период, 3 ряд
№26 Ar(Fe) = 56 (26p, 30n)26ℯ
Схема строения атома: Fe +26 )2 )8 )14 )2
Слайд 12Что можно дополнительно сказать о железе на основании положения его в
Fe – VIIIБ группа, 3 период, 3 ряд
№26 Ar(Fe) = 56 (26p, 30n)26ℯ
Схема строения атома: Fe +26 )2 )8 )14 )2
Электронная формула атома:
1s2 2s2 p6 3s2 3p6 3d6 4s2 4p0 4d0
Слайд 13Что можно дополнительно сказать о железе на основании положения его в
Fe – VIIIБ группа, 3 период, 3 ряд
№26 Ar(Fe) = 56 (26p, 30n)26ℯ
Схема строения атома: Fe +26 )2 )8 )14 )2
Электронная формула атома
1s2 2s2 p6 3s2 3p6 3d6 4s2 4p0 4d0
Валентность – II, III
Слайд 14Что можно дополнительно сказать о железе на основании положения его в
Fe – VIIIБ группа, 3 период, 3 ряд
№26 Ar(Fe) = 56 (26p, 30n)26ℯ
Схема строения атома: Fe +26 )2 )8 )14 )2.
Электронная формула атома
1s2 2s2 p6 3s2 3p6 3d6 4s2 4p0 4d0
Валентность – II, III
Степень окисления – 0, +2, +3, (реже +4,+6)
Слайд 15Что можно дополнительно сказать о железе на основании положения его в
Fe – VIIIБ группа, 3 период, 3 ряд
№26 Ar(Fe) = 56 (26p, 30n)26ℯ
Схема строения атома: Fe +26 )2 )8 )14 )2.
Электронная формула атома
1s2 2s2 p6 3s2 3p6 3d6 4s2 4p0 4d0
Валентность – II, III
Степень окисления – 0, +2, +3, (реже +4, +6)
BO – Fe2O3 гидроксид - Fe(OH)3
Слайд 16Нахождение в природе
Было время, когда железо ценилось дороже золота. Богачи заказывали
Железо - металл войны. Недаром алхимики обозначали его знаком бога войны Марса: щит и копье.
В земной коре – 2 место из металлов – 5%. В древности его назвали «небесным камнем», так как он входит в состав метеоритов.
Природные соединения:
магнетит (магнитный железняк) – Fe3O4;
гематит (красный железняк) – Fe2O;
бурый железняк – FeO(OH);
лимонит – Fe2O3 • nH2O;
пирит (серный колчедан)– FeS2;
сидерит – FeCO3.
Слайд 17Получение
Железо получают в виде сплава восстановлением из его соединений при
Слайд 18Получение
Железо получают в виде сплава восстановлением из его соединений при высоких
FeO + H2 = Fe + H2O
Слайд 19Получение
Железо получают в виде сплава восстановлением из его соединений при высоких
FeO + H2 = Fe + H2O
Fe2O3 + 2Al = 2Fe + Al2O3
Слайд 20Получение
Железо получают в виде сплава восстановлением из его соединений при высоких
FeO + H2 = Fe + H2O
Fe2O3 + 2Al = 2Fe + Al2O3
Fe3O4 + 4CO = 3Fe + 4CO2↑
Слайд 21Физические свойства
Fe – металл серебристо – белого цвета, имеет металлический блеск,
с плотностью 7,87 г/см3, tпл = +15390С, легко намагничивается и размагничивается.
Слайд 22Физические свойства
Fe – металл серебристо – белого цвета, имеет металлический блеск,
с плотностью 7,87 г/см3, tпл = +15390С, легко намагничивается и размагничивается.
Fe – М, Ц(с-б), Бл, Т, Пл, = 7,87 г/см3,
tпл = +15390С, легко намагничивается и размагничивается.
Слайд 25Химические свойства
Окисляется активными неметаллами:
Fe + S = FeS 2Fe + 3Cl2 =
Горит в кислороде с треском:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
Слайд 26Химические свойства
Окисляется активными неметаллами:
Fe + S = FeS 2Fe + 3Cl2 =
Горит в кислороде с треском:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
Взаимодействует с парами воды:
Fe + H2O = FeO + H2↑
Слайд 27Химические свойства
Окисляется активными неметаллами:
Fe + S = FeS 2Fe + 3Cl2 =
Горит в кислороде с треском:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
Взаимодействует с парами воды:
Fe + H2O = FeO + H2↑
Во влажном воздухе железо покрывается ржавчиной - смесью продуктов окисления (оксидами и гидроксидами)
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Слайд 28Химические свойства
Взаимодействует с кислотами (кроме HNO3(конц) и H2SO4(конц)):
Fe + 2HCl =
Fe + H2SO4(разб) = FeSO4 + H2↑
Слайд 29Химические свойства
Взаимодействует с кислотами (кроме HNO3(конц) и H2SO4(конц)):
Fe + 2HCl =
Fe + H2SO4(разб) = FeSO4 + H2↑
Вытесняет менее активные металлы из их солей:
Fe + CuSO4 = FeSO4 + Cu↓
Слайд 30Соединения железа.
I. FeO – порошок черного цвета, нерастворим в воде.
FeO + H2SO4(разб) = FeSO4 + H2O
II. Fe2O3 – красно-бурый порошок, нерастворим в воде. Для него также характерны основные свойства:
Fe2O3 + 3H2SO4(разб) = Fe2(SO4)3 + 3H2O
III. Fe(OH)2 и Fe(OH)2 – нерастворимые в воде гидроксиды можно получить при взаимодействии соответствующих солей с щелочами:
FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4 FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
зеленоватый осадок красно-бурый осадок
Fe(OH)2 – типичное основание:
Fe(OH)2 + 2HNO3 = Fe(NO3)2 + 2H2O
Он неустойчив, на воздухе медленно окисляется кислородом:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
Fe(OH)3 – проявляет слабые амфотерные свойства, растворяясь в кислотах и в концентрированных щелочах при нагревании:
Fe(OH)3 + 3HNO3 = Fe(NO3)3 + 3H2O Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Гидроксиды железа разлагаются при нагревании:
Fe(OH)2 → FeO + H2O 2Fe(OH)3→ Fe2O3 + 3H2O
IV. Соли – как производные нерастворимых гидроксидов гидролизуются в воде с образованием кислой среды:
Fe2+ + H2O ↔ FeOH+ + H+
FeOH+ + H2O ↔ Fe(OH)2 + H+
Соли железа можно узнать по качественным реакциям с щелочами:
Fe2+ + 2OH- - Fe(OH)2↓ Fe3+ + 3OH- = Fe(OH)3↓
зеленый осадок бурый осадок
Слайд 31Биологическая роль железа
Биохимики открыли важную роль железа в жизни растений, животных
Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных..
В теле взрослого человека имеется до 4 г железа, 65% которого находится в гемоглобине крови, который придает ей красный цвет и осуществляет транспортировку кислорода от органов дыхания к различным тканям. Недостаток железа в крови плохо отражается на здоровье человека, у него возникает малокровие.
Слайд 32Биологическая роль железа
Железо необходимо и растениям. Оно входит в состав цитоплазмы,
Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
Связанное железо содержится во многих пищевых продуктах: ржаном хлебе, картофеле, яблоках, абрикосах, гречневой крупе, шпинате.
Слайд 33Применение.
Чистое железо применяется для изготовления деталей электромагнитного оборудования, где требуется способность
Слайд 34
Самостоятельная работа
Определите степени окисления железа в соединениях:
FеСl3, FеSО4, Fе(ОН)2, Fе(ОН)3, Fе2(SО4)3,
Слайд 35Самостоятельная работа
Определите степени окисления железа в соединениях:
FеСl3, FеSО4, Fе(ОН)2, Fе(ОН)3, Fе2(SО4)3,
+3 +2 +2 +3 +3 +2
Слайд 37Тест
По распространенности в земной коре железо составляет:
в) 10%
с) 15%
В каком из предложенных фруктов наибольшая массовая доля железа:
а) Лимон
в) Груша
с) Яблоко?
Явление намагничивания железа и его сплавов нашло широкое применение в:
а) Строительстве
в) Теплотехнике
с) Радиотехнике
Постоянное по массе содержание железа в организме человека:
а) 3 – 5 г
в) 5 – 7 г
с) 7 – 9 г
Химический элемент, злейший враг железа:
а) Хлор
в) Кислород
с) Азот
Какие степени окисления проявляет железо в своих соединениях:
а) +1, +2
в) +2, +3
с) +1, +3?
Слайд 39Домашнее задание
§35, стр. 118-120, упр. 8-9, стр. 121 (коричневая)
§42-43, стр. 129-134,
Слайд 40Задание:
Разгадав ключевые слова и заменив цифры буквами по горизонтальным рядам, прочитайте
Слайд 42Вопросы к заданию
Бог войны, атрибуты которого использовали алхимики для обозначения железа
Зеленый овощ, содержащий железо – 18, 14, 7, 12, 1, 17.
Один важных компонентов крови, содержащее железо – 4, 6, 11, 13, 4, 10, 13, 2, 7, 12
Природное соединение железа, называемое еще пирит – 16, 6, 15, 12,22, 9, 8, 13, 10, 23, 6, 5, 1, 12
Лабораторный прибор, используется для закрепления пробирок – 18, 14, 1, 17, 7, 3
Минерал, содержащий железо – 24, 1, 10, 19, 8, 13, 14, 7, 15, 7, 17
Состояние здоровья человека, при лечении которого используются железосодержащие препараты – 25, 14, 1, 5, 13, 8 16, 7, 10
Слайд 43
Пир Соломона (легенда)
Рассказывают, что после окончания строительства Иерусалимского храма мудрый царь
- Ну, а кто же у строителей самый главный? Без кого нельзя было бы построить наш чудо-храм?
Поднялся каменщик и сказал:
- Конечно я – главный! Мы, каменщики – выложили весь храм по кирпичику. Какие стены, своды, арки, фундамент! Храм – это, безусловно, мы!
- Это не так, - возразил плотник, - ведь, если бы не было наших лесов, каменщики никогда бы не смогли построить храм. А наши стропила? Они из лучшего ливанского кедра!
А паркет из пальмовых дощечек? Конечно, основа храма каменная, но без нашей работы это был бы не храм, а ободранные голые стены!
- Оба вы хвастуны! – закричал землекоп. – Хотел бы я знать, как можно построить храм, не вырыв под него котлован. Да ваш храм слетел бы от первого порыва ветра! Конечно, мы, землекопы, и есть главные строители храма!
Высказывали свое мнение и представители других специальностей
Слайд 44Но царь Соломон недаром был прозван мудрым. Подозвав к себе каменщика,
- Кто делал твой инструмент?
- Конечно, кузнец, - ответил удивленный каменщик.
- А твой?- спросил царь у плотника.
- Кузнец, - не задумываясь, ответил тот.
- А твои лопату и кирку? – поинтересовался Соломон у землекопа.
- Кузнец.
Тогда царь встал, подошел к угловому столику и вывел на середину зала скромного, закопченного человека в кожаном переднике.
- Вот он, главный строитель храма! – воскликнул Соломон.
Он усадил кузнеца на возвышение рядом с собой и поднес ему хорошую чарку вина!
В этой легенде отразилось значение, которое издревле имело железо в жизни человека.